
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下
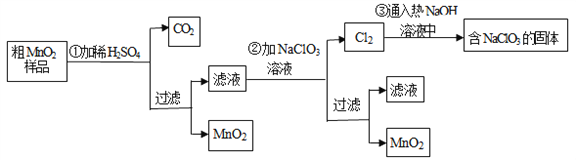
(1)第①步加稀H2SO4时,粗MnO2样品中的_____________(写化学式)转化为可溶性物质.
(2)第②步反应的离子方程式:_______________________
(3)流程中得到MnO2固体操作必需的玻璃仪器有玻璃棒、烧杯、_______________。
(4)已知第③步蒸发得到的固体中有NaClO3和NaOH,则一定还有含有_________(写化学式).其中用到Cl2的实验室制法的反应离子方程式:_______________________。
(5)若粗MnO2样品的质量为50.76g,第①步反应后,经过滤得到34.8gMnO2,并收集到0.896LCO2(标准状况下),则在第②步反应中至少需要____________ gNaClO3.[M (NaClO3)=106.5]
(6)第①步酸溶产生的CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2]。己知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g); ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式______________。
【答案】MnO、MnCO32ClO3-+4H2O+5Mn2+=5MnO2↓+Cl2↑+8H+漏斗NaCl4H++ MnO2+2Cl-![]() Cl2↑+Mn2++2H2O8.522NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l); ΔH=–87.0kJ·mol-1
Cl2↑+Mn2++2H2O8.522NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l); ΔH=–87.0kJ·mol-1
【解析】
试题分析:由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体,结合选项分析解答。
解析:由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体,则
(1)只有MnO2不与硫酸反应,则MnO和MnCO3转化为可溶性物质;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:2ClO3-+4H2O+5Mn2+=5MnO2↓+Cl2↑+8H+;
(3)流程中得到MnO2固体操作是过滤,必需的玻璃仪器有玻璃棒、烧杯、漏斗;
(4)Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl;实验室制备氯气的离子方程式为4H++ MnO2+2Cl-![]() Cl2↑+Mn2++2H2O ;
Cl2↑+Mn2++2H2O ;
(5)由题意知样品中的MnO和MnCO3质量为50.76g-34.8 g=15.96g。0.896LCO2(标准状况下)是0.04mol,由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.04mol,质量为115g/mol×0.04mol=4.6g,所以MnO的质量为15.96g-4.6g=11.36g,其物质的量为11.36g÷71g/mol=0.16mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.20mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.08mol,质量是0.08mol×106.5g/mol=8.52g;
(6)己知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
则根据盖斯定律可知①-②-③即得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=–87.0kJ·mol-1。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I.将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II.向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III.过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV.将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。
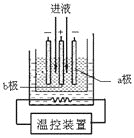
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是________元素(填元素名称,后面小题相同),它在周期表中的位置为______________。
(2)乙是________元素,写出与乙同主族第六周期元素对应碱的电子式___________________。
(3)丙是________元素,最高价氧化物对应水化物的化学式是_________________;
(4)丁是________元素,甲与丁两种元素形成既有离子键又有共价键物质的化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
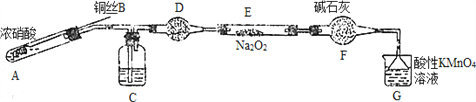
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.全部由非金属组成的化合物可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
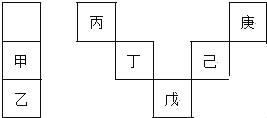
A. 丙与戊的原子序数相差28
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,庚和乙形成的化合物易溶于水
D. 丁的最高价氧化物不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
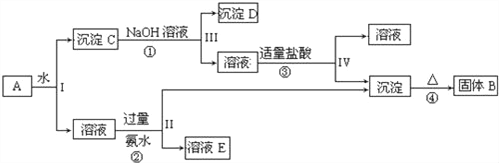
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B______;C________;沉淀D_____;溶液E________.
(3)写出①、②、③、④四个反应方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com