
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
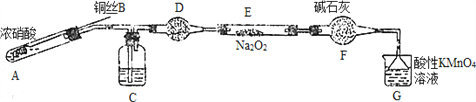
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
【答案】分别取两种固体样品少量于试管中加水溶解; 再分别滴加酚酞试液, 变红的为NaNO2可以控制反应的发生与停止Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OCbc6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O69%
【解析】
试题分析:Ⅰ.根据NaNO2为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性分析;
Ⅱ.装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮、硝酸铜和水,装置C中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮;通过装置D中的干燥剂吸收水蒸气,通过装置F中的干燥剂防止水蒸气进入,通过装置E中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,据此分析解答。
解析:Ⅰ.酸越弱相应酸根越容易水解,溶液碱性越强,因此鉴别NaNO2和NaCl两种固体的方法是:分别取两种固体样品少量于试管中加水溶解,再分别滴加酚酞试液,变红的为NaNO2;
Ⅱ.(1)可通过上下移动铜丝控制反应是否进行,所以使用铜丝的优点是可以控制反应的发生与停止;
(2)浓硝酸和铜加热发生反应生成二氧化氮、硝酸铜和水,方程式为:Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O ;通过装置C中的水与二氧化氮反应生成硝酸和一氧化氮;通过装置F中的干燥剂防止水蒸气进入与过氧化钠反应,所以C中的药品是水,答案选C;
(3)①a.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标注)×V(标准)/V(待测)可知,c(标准)不变,a错误;b.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标注)×V(标准)/V(待测)可知,c(标准)偏大,b正确;c.滴定终点时仰视读数,造成V(标准)偏大,根据c(待测)=c(标注)×V(标准)/V(待测)可知,c(标准)偏大,c正确;答案选bc;
②该反应中亚硝酸根离子被氧化为硝酸根离子,高锰酸根离子被还原为锰离子,离子方程式为 6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O;
③根据表中数据可知第一次实验数据误差太大,舍去,消耗高锰酸钾溶液体积的平均值是0.02L,高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O可知,亚硝酸钠的物质的量是0.002mol×5/2=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×100mL/25mL=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数1.38g/2g×100%=69.0%.


科目:高中化学 来源: 题型:
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A. 盐酸、天然气、醋酸、干冰 B. 胆矾、漂白粉、氯化钾、氯气
C. 氯化钠、福尔马林、硫酸钠、乙醇 D. 单甘油酯、混甘油酯、苛性钾、石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选题)下列有关硫酸的化学事实与硫酸表现出的性质(括号中)的描述中,正确的是( )
A.久置在敞口容器中的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铁与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应的“黑面包”实验(吸水性)
D.浓硫酸与氯化钠固体反应制HCl(难挥发性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.HCl溶于水只需克服分子间作用力
D.干冰升华时,分子内共价键会发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下
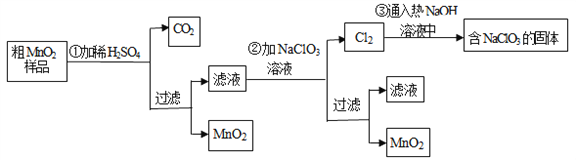
(1)第①步加稀H2SO4时,粗MnO2样品中的_____________(写化学式)转化为可溶性物质.
(2)第②步反应的离子方程式:_______________________
(3)流程中得到MnO2固体操作必需的玻璃仪器有玻璃棒、烧杯、_______________。
(4)已知第③步蒸发得到的固体中有NaClO3和NaOH,则一定还有含有_________(写化学式).其中用到Cl2的实验室制法的反应离子方程式:_______________________。
(5)若粗MnO2样品的质量为50.76g,第①步反应后,经过滤得到34.8gMnO2,并收集到0.896LCO2(标准状况下),则在第②步反应中至少需要____________ gNaClO3.[M (NaClO3)=106.5]
(6)第①步酸溶产生的CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2]。己知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s); ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CONH2)2(s)+H2O(g); ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
D | 乙醇(乙酸) | 饱和Na2CO3溶液 | 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
A.R的氧化物一定能溶于水
B.R的最高价氧化物对应水化物是H2RO3
C.R的氢化物的水溶液呈碱性
D.R的氧化物都能与NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com