
【题目】用R代表短周期元素,R最外层的2p能级上的未成对电子有3个,下列关于R的描述正确的是( )
A.R的氧化物一定能溶于水
B.R的最高价氧化物对应水化物是H2RO3
C.R的氢化物的水溶液呈碱性
D.R的氧化物都能与NaOH反应
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
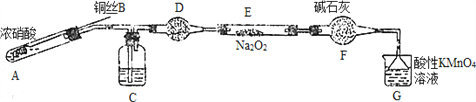
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g)2SO3(g),平衡混合体系中 SO3的百分含量和温度的关系如图1所示,根据图1回答下列问题:
①2SO2(g)+O2(g)2SO3(g)的△H____0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是____.
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol 电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图2表示在此反应过程中的能量的变化,图3表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图4表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
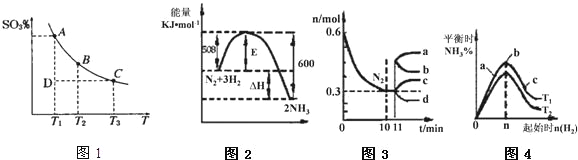
①该反应的平衡常数表达式为_____,升高温度,平衡常数______(填“增大”或“减小”或“不变”).
②由图2信息,计算0~10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为______(填“a”或“b”或“c”或“d”).
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______点,温度T1______T2(填“>”或“=”或“<”).
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_____性,所得溶液中c(H+)﹣c(OH﹣)=_________________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电极的说法正确的是
A. 铜电极只能作正极 B. 电解精炼铜时,纯铜与电源正极相连
C. 原电池的负极得到电子 D. 电解池的阳极失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意回答问题:
(1)中和热的测定所需的玻璃仪器有:大小烧杯、量筒、温度计、 ;
已知:0.55 mol·L-1 HCl和0.50 mol·L-1的NaOH溶液各50 mL反应放出热量为1.42kJ,写出该反应的中和热的热化学方程式: 。
(2)101kpa时,1克乙醇(CH3CH2OH)液体完全燃烧生成稳定氧化物放出热量akJ,写出乙醇燃烧热的热化学方程式: 。
(3)已知H-H、O=O和O-H键的键能分别为436 kJ/mol、498 kJ/mol和463 kJ/mol,2H2O(g) = 2H2(g)+ O2(g) ΔH2= 。
(4)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g ![]() CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g ![]() CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g ![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为: 。
(5)① 25℃时,浓度均为0.1 mol/L的①氨水②氢氧化钠溶液③盐酸溶液④醋酸溶液,其c(H+)由大到小排列的顺序为: (用序号填空)。
② 95℃时,水中的H+的物质的量浓度为10-6 mol·L-1,若把0.01 mol的NaOH固体溶解于95℃水中配成1 L溶液,则溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中最活泼的金属元素是____(填写元素符号,以下同),非金属性最强的元素是_____;
(2)③与④的最高价氧化物对应水化物的碱性较弱的是__________(填写化学式)。
(3)工业制取⑤的单质的化学反应方程式为:____________________。⑤的气态氢化物在空气中燃烧生成两种氧化物,写出该反应的化学方程式:______________。
(4)写出一个能比较⑦、⑩单质氧化性强弱的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十世纪化学合成技术的发展对人类健康和生活质量的提高作出了巨大贡献。下列各组物质全部由化学合成得到的是( )
A. 玻璃 纤维素 青霉素 B. 尿素 食盐 聚乙烯
C. 涤纶 洗衣粉 阿司匹林 D. 石英 橡胶 磷化铟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com