
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
【答案】碳 氧 钠 硫 三 ⅥA ![]() 共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2
共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2 ![]()
【解析】
A和B具有相同的电子层数,即A和B位于同周期,A的L层电子数是K层电子数的两倍,即A为C,C在空气中燃烧时呈现黄色火焰,即C为Na,Na在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,即B为O,D为S。
(1) A和B具有相同的电子层数,即A和B位于同周期,A的L层电子数是K层电子数的两倍,即A为C,C在空气中燃烧时呈现黄色火焰,即C为Na,Na在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,即B为O,D为S;
(2)D为S,位于第三周期VIA族;S2-的结构示意图为![]() ;
;
(3)AB2化学式为CO2,CO2属于共价化合物;C2B2的化学式为Na2O2,其电子式为![]() ,含有离子键、(非极性)共价键;CO2与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2;
,含有离子键、(非极性)共价键;CO2与Na2O2反应:2Na2O2+2CO2=2Na2CO3+O2;
(4)C2D的化学式为Na2S,属于离子化合物,即用电子式表示化合物形成过程:![]() 。
。


科目:高中化学 来源: 题型:
【题目】为确定由硝酸银和硝酸钠组成的混合物中硝酸银的含量,实验室可采用多种方法测定。现取两份不同质量的该混合物进行如下实验:
I.方法一:采用“佛尔哈德法”测定。“佛尔哈德法”可用于测定含银离子的硝酸溶液中银离子的含量,该方法是以铁铵钒[FeNH4(SO4)2·12H2O]为指示剂,NH4SCN溶液为标准溶液。从滴定开始到滴定终点,溶液中发生的主要反应有:
①Ag+(aq)+SCN-(aq)=AgSCN(s)(白色)
②Fe3++SCN-=Fe(SCN)2+(红色)
取14.0 g该混合物溶于蒸馏水配成500 mL待测溶液。取出25.00 mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50 mL滴入指示剂铁铵钒溶液,用0.1000 mol·L-1的NH4SCN标准溶液滴定,消耗标准溶液35.00 mL。
(1)该滴定不能在中性或碱性条件下进行是因为Fe3+会转化为_________(填化学式,下同),Ag+会转化为___________。
(2)当滴入25.00 mL标准溶液时,锥形瓶中_________(填“有”或“没有”)沉淀生成。
(3)滴定终点溶液颜色的变化为________。
(4)称量混合物时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量________(填“偏高”或“偏低”或“无影响”)。
(5)该混合物中硝酸银的质量分数为___________(保留三位有效数字)。
II.方法二:取m g该混合物溶于水配成500 mL溶液,取出50.00 mL溶液于锥形瓶中加入过量的稀盐酸充分反应,经“一系列操作”可得到纯净干燥的AgCl固体2.87 g。根据要求回答下列问题:
(6)“一系列操作”的具体步骤为__________、低温干燥。
(7)该混合物质量m=____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源,下列说法不正确的是
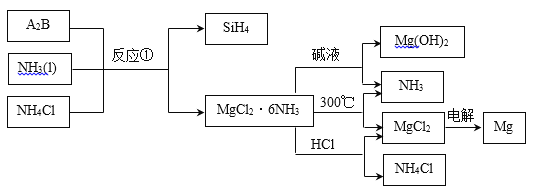
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,最终得到的固体不同
D.MgCl2·6NH3所含部分元素的原子半径由小到大的顺序H<Cl<Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③为__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗新型冠状病毒中发挥了一定的作用,其有效成分绿原酸的结构简式如图,下列有关说法不正确的是( )

A.绿原酸属于芳香族化合物
B.分子中至少有 7个碳原子共面
C.1mol 绿原酸最多可消耗5 mol NaOH或4molBr2
D.与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______;从组成和性质上分析,丁属于_______(填“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是__________(填化学式);根据氯元素的化合价判断,乙物质__________。
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是______。
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为_________。
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com