
【题目】下列化工工艺可得到汽油的是 ( )
A. 裂化 B. 常压分馏 C. 裂解 D. 催化重整
科目:高中化学 来源: 题型:
【题目】CH3CH2CH=CH2是来自石油基本化工原料,现有如下转化关系:

己知:C为醛
(l)上述各步反应中所属反应类型分别为:______,______,______,______,______。
(2)A、B、C、D、G中官能团名称______,______,______,______,______。(官能团,是决定有机化合物的化学性质的原子或原子团。)
(3)B和D反应进行比较缓慢,请说出提高该反应速率的2种方法___________。
(4)写出属于醇但不能被O2催化氧化生成醛的B的所有同分异构体的结构简式________。
(5)写出除③外的各步反应的化学方程式:
① A→B:______________;
② B→C: ______________;
④ B+足量D→G: ______________;
⑤ G+ Na0H→B+E: ______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
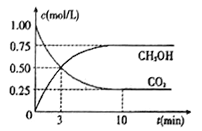
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,在元素组成上最相似的一组是
A. 核糖、核糖核苷酸、脱氧核糖核酸
B. 乳酸、脂肪酸、丙酮酸
C. 性激素、胰岛素、抗体
D. 淀粉、淀粉酶、控制淀粉酶合成的基因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中c(H+)=![]() molL-1
molL-1
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列有关叙述正确的有( )
①标准状况下,20 g 重水(D2O)中含有的电子数为 10NA
②0.5 molFe2+被足量的 H2O2 溶液氧化,转移 0.5NA个电子
③将 2 mol NO 和 1 mol O2 混合后,体系中的分子总数为 3NA
④乙烯和环丙烷组成的 42 g 混合气体中氢原子的个数为 6NA
⑤2 molL﹣1 碳酸钠溶液中 Na+的数目是 2NA
⑥10LpH=1 的硫酸溶液中含有的 H+数为 2NA
⑦22.4 L 的 N2 的共用电子对数为 3NA
⑧将 0.1mol 氯化铁溶于 1L 水中,所得溶液含有 NA0.1个 Fe3+.
A.①④⑥ B.②③④ C.①②④ D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是
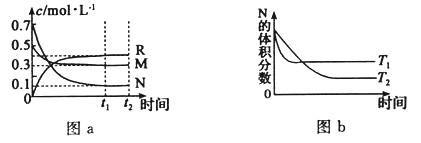
A.该反应的热化学方程式M(g)+3N(g)![]() 2R(g)△H>0
2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com