
����Ŀ��ʳƷ����Ĥ�����ʷֱ�Ϊ����ϩ (PE )��������ϩ (PVC )����ƫ������ϩ (PVDC )�����ࡣ ���� PE �� PVDC �ǰ�ȫ�ġ�PVC �������DZ��Σ����Ҫ��Դ���������棺��Ʒ������ϩ������������ӹ�������ʹ�õļӹ����������༰������
(1)д������ϩ������ϩ�ֱ���������ϩ�;�����ϩ�Ļ�ѧ����ʽ����ϩ������ϩ (PE )��_____ ����ϩ��������ϩ (PVC )��_____ �ճ��õ�ʳƷ����Ĥ��ѡ��_____��
(2)Ŀǰ���ֵ�����ճ��������ճ�͵������̻������ͳ��ߣ������ܾ��DZ�����һ�ֽ������ظ�������Ϳ�㣬ʵ���Ͼ��DZ���Ϊ�����������ľ��ķ���ϩ�����ĵ����ķ���ϩ�Ľṹ��ʽ��_____���ϳ��ظ����ķ�Ӧ������_____����Ӧ����ʽΪ_____��
(3)���ķ���ϩ�ķ���Դ��һ��ʵ�����⡣1938 �꣬��ѧ����³�������������о��ķ���ϩ�ľۺϷ�Ӧ�����ǽ��ķ���ϩ������������еļ�ѹ��ƿ�У�������ƿ�뷴Ӧ���ܵ�����Ӧ�� (�ܵ� ����Ӧ����϶�п��� )��ͨ�������ϣ��ķ���ϩ���岢û��ͨ����Ӧ���У�������֤����ƿ������һ��û���٣�����Ҳû���ķ���ϩ�����ݳ�������ж���ź�ȴ�Ӹ�ƿ�������ķ���ϩ���صİ�ɫ��ĩ�����ķ���ϩ���ڸ�ƿ�з����˾ۺϷ�Ӧ����ȷ֤���ð�ɫ��ĩ���Ǿ��ķ���ϩ��1945 �꣬�����Ű˾��ʼ�ڹ�ҵ��ģ���������ķ���ϩ���ɴ˿�����֪�÷�Ӧ��������_____��_____��_____������
(4 )��ճ�����ڱ���һ������ķ���ϩͿ�㣬����ò�ճ���շ���ʱ����ճ��������˵����ȷ����_____
a�����ķ���ϩ������û��˫��
b�����ķ���ϩ�ĵ����Dz�������
c�����ķ���ϩ�Ļ�ѧ���ʺܲ�����
d�����ķ���ϩ���۷е�ܵ�
��Ȳ��һ����Ҫ�Ļ����л�ԭ�ϣ���һ�����������ܱ��ϵ��ͼ��

��֪��B ��һ�����ϣ�75%�� D ��Һ��ҽҩ���������������Իش��������⣺
(5)����Ȳ��һ��̼ԭ�ӵ�ͬϵ��Ľṹ��ʽ��_____��
(6)A ���ʵĽṹ��ʽ��_____��A��B ��Ӧ������_____��Ӧ��
(7)�����¸�����Ӧ�Ļ�ѧ����ʽ����Ȳ��A��_____ ��Ȳ��C��_____ C��D��_____
���𰸡�![]()
![]() ����ϩ CF2��CF2 �Ӿ۷�Ӧ
����ϩ CF2��CF2 �Ӿ۷�Ӧ ![]() ���� ��ѹ ���� ac CH��C��CH3 CH2��CHCl �Ӿ� CH��CH+HCl
���� ��ѹ ���� ac CH��C��CH3 CH2��CHCl �Ӿ� CH��CH+HCl![]() CH2��CHCl CH��CH+H2
CH2��CHCl CH��CH+H2![]() CH2��CH2 CH2��CH2+H2O
CH2��CH2 CH2��CH2+H2O![]() CH3CH2OH
CH3CH2OH
��������
(1 )��ϩ������ϩ������̼̼˫�����ɷ����Ӿ۷�Ӧ���ɸ߾���ճ��õ�ʳƷ����ĤӦѡ�þ���ϩ��������ϩ�������к���
(2 )�ķ���ϩ�ṹ��ʽΪCF2��CF2������̼̼˫�������ɾ��ķ���ϩ��
(3 )�������Ϣ��֪��Ӧ������Ϊ���¡���ѹ��������
(4 )���ķ���ϩΪ�ķ���ϩ�ľۺ������̼̼˫��������FԪ�أ�Ϊ������������ʽ�Ϊ�ȶ����۷е�ϸߣ�
(5 )�� (7 )��Ȳ����C��C�����ɷֱ���HCl�����������ӳɷ�Ӧ����ת����ϵ��֪AΪCH2��CHCl��BΪ������ϩ��CΪ��ϩ��DΪ�Ҵ����Դ˽����⡣
(1 )��ϩ������ϩ������̼̼˫�����ɷ����Ӿ۷�Ӧ���ɸ߾������ʽΪ![]() ���ճ��õ�ʳƷ����ĤӦѡ�þ���ϩ������ʽΪ
���ճ��õ�ʳƷ����ĤӦѡ�þ���ϩ������ʽΪ![]() ��������ϩ�������к���Ӧѡ�����ϩ��
��������ϩ�������к���Ӧѡ�����ϩ��
�ʴ�Ϊ��![]() ��
�� ![]() ������ϩ��
������ϩ��
(2 )�ķ���ϩ�Ľṹ��ʽΪCF2��CF2������̼̼˫�����ɷ����Ӿ۷�Ӧ���ɾۺ����Ӧ�ķ���ʽΪ![]() ��
��
�ʴ�Ϊ��CF2��CF2���Ӿ۷�Ӧ��![]() ��
��
(3 )�������Ϣ�н��ķ���ϩ������������еļ�ѹ��ƿ�У��ܵ�����Ӧ����϶�п�������֪��Ӧ������Ϊ���¡���ѹ���������ʴ�Ϊ�����¡���ѹ��������
(4 )���ķ���ϩΪ�ķ���ϩ�ľۺ������̼̼˫��������FԪ�أ�Ϊ������������ʽ�Ϊ�ȶ����۷е�ϸߣ��ʴ�Ϊ��a��c��
(5 )����Ȳ��һ��̼ԭ�ӵ�ͬϵ��Ľṹ��ʽ��CH��C��CH3���ʴ�Ϊ��CH��C��CH3��
(6 )�����Ϸ�����֪AΪCH2��CHCl��A�����Ӿ۷�Ӧ���ɾ�����ϩ���ʴ�Ϊ��CH2��CHCl���Ӿۡ�
(7 )��Ȳ��HCl�����ӳɷ�Ӧ��������ϩ������ʽΪCH��CH+HCl![]() CH2��CHCl����Ȳ�����������ӳɷ�Ӧ������ϩ������ʽΪCH��CH+H2
CH2��CHCl����Ȳ�����������ӳɷ�Ӧ������ϩ������ʽΪCH��CH+H2![]() CH2��CH2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�������ʽΪCH2��CH2+H2O
CH2��CH2����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�������ʽΪCH2��CH2+H2O![]() CH3CH2OH��
CH3CH2OH��
�ʴ�Ϊ��CH��CH+HCl![]() CH2��CHCl��CH��CH+H2
CH2��CHCl��CH��CH+H2![]() CH2��CH2��CH2��CH2+H2O
CH2��CH2��CH2��CH2+H2O![]() CH3CH2OH��
CH3CH2OH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������Ϊx��Ԫ��E�����ڱ���λ��A��B��C��D����Ԫ���м�(��ͼ��ʾ)����A��B��C��D����Ԫ�ص�ԭ������֮�Ͳ�������(��ϵ���ϵ��0��Ԫ�س���)(����)
A. 4xB. 4x��14
C. 4x��10D. 4x��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪34Se��ԭ�ӽṹʾ��ͼ��ͼ��ʾ���ش��������⣺

��1��Se��Ԫ�����ڱ��е�λ����__________��
��2����Se�����ڱ��е�λ�÷����ж�����˵����ȷ����__________��
A�����ȶ��ԣ�PH3>H2S>H2Se B����ԭ�ԣ�H2Se>HBr>HCl
C�����Ӱ뾶��Se2->Cl->K+ D�����ԣ�HClO3>HBrO3>H2SeO3
�����¶�t1��t2�£�X2(g)��H2��Ӧ����HX��ƽ�ⳣ�����±���
��ѧ����ʽ | K(t1) | K(t2) |
F2+H2===2HF | 1.8��1036 | 1.9��1032 |
Cl2+H2===2HCl | 9.7��1012 | 4.2��1011 |
Br2+H2===2HBr | 5.6��107 | 9.3��106 |
I2+H2===2HI | 43 | 34 |
��1����֪��HX�����ɷ�Ӧ�Ƿ��ȷ�Ӧ�����¶�t2__________t1���<����>������
��2���õ���ʽ��ʾHX���γɹ���__________��
��3�����ۼ��ļ����湲�õ��Ӷ�ƫ�Ƴ̶ȵ��������ǿ��HX���ۼ��ļ�����ǿ������˳����__________��
��4��X2������H2��Ӧ����HX����ԭ�ӽṹ����ԭ��__________��
��5��K�ı仯���ֳ�X2��ѧ���ʵĵݱ��ԣ���ԭ�ӽṹ����ԭ��__________��ԭ�Ӱ뾶�����õ�������������
��6��������K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ�__________��ѡ����ĸ����
a������ͬ�����£�ƽ��ʱX2��ת�������� b��HX���ȶ�������
c��X2��H2��Ӧ�ľ��ҳ̶����� d��HX�Ļ�ԭ������
��7����ͬ±��ԭ��֮����γ�±�ػ������������±�ص��������д��BrCl��SO2��ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽ__________��
���𰸡� ��4���ڵڢ�A�� BC > ![]() HF��HCl��HBr��HI ±��ԭ�ӵ���������������7 ͬһ����Ԫ�ش�������ԭ�Ӻ�����Ӳ����������� ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
HF��HCl��HBr��HI ±��ԭ�ӵ���������������7 ͬһ����Ԫ�ش�������ԭ�Ӻ�����Ӳ����������� ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
��������I.(1). ����Se��ԭ�ӽṹʾ��ͼ��֪��Se���ĸ����Ӳ㣬�������6�����ӣ�����Ӳ�������������������������������������������SeԪ��λ��Ԫ�����ڱ��ĵ�4���ڵ�VIA�壬�ʴ�Ϊ����4���ڵ�VIA����
(2) A. ͬһ���ڴ�����Ԫ�صķǽ���������ǿ��ͬһ������ϵ���Ԫ�صķǽ�������������ǽ�����S��P��S��Se������Ԫ�صķǽ�����Խǿ������̬�⻯�����ȶ���Խǿ���������ȶ���H2S��PH3��H2S��H2Se����A����B. �ǽ�����Cl��Br��Se����ǽ�����Խǿ�����Ӧ�����ӵĻ�ԭ��Խ������ԭ�ԣ�H2Se>HBr>HCl����B��ȷ��C. ���Ӳ���Խ�࣬���Ӱ뾶Խ�������Ӱ뾶Se2->Cl-��������ͬ��������Ų������ӣ�ԭ������Խ�����Ӱ뾶ԽС�������Ӱ뾶Cl->K+���������Ӱ뾶��Se2->Cl->K+����C��ȷ��D. ����������Ӧ��ˮ��������Խǿ��Ԫ�صķǽ�����Խǿ����HClO3��HBrO3��H2SeO3�����Ǹ�Ԫ�ص�����������Ӧ��ˮ����������Ƚ�����ǿ������D����ѡBC��
II. (1). ��HX�����ɷ�Ӧ�Ƿ��ȷ�Ӧ���������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С���ɱ������ݿ�֪��K(t1)��K(t2)��˵��t2��t1���ʴ�Ϊ������
(2). ��HX���ǹ��ۻ������ԭ������������Xԭ�����������γ�һ�Թ��õ��Ӷԣ����γɹ��̿ɱ�ʾΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3). F��Cl��Br��I���ڢ�A��Ԫ�أ�ͬ����Ԫ�����϶������ź˵����������ԭ�Ӻ�����Ӳ��������࣬����ԭ�Ӱ뾶���������ԭ�Ӻ˶��������ӵ��������������Ӷ����·ǽ�������������������Ԫ�صõ����ӵ���������������HF���ļ�����ǿ��HI�ļ������������HX���ۼ��ļ�����ǿ������˳����HF��HCl��HBr��HI���ʴ�Ϊ��HF��HCl��HBr��HI��
(4). ±��ԭ�ӵ�������������Ϊ7�����ڷ�Ӧ�о��õ�1�����Ӷ��ﵽ8���ӵ��ȶ��ṹ����Hԭ���������һ�����ӣ��ڷ�Ӧ��Ҳ�ܵõ�1�����Ӷ��ﵽ2���ӵ��ȶ��ṹ�����±�ص�������������ʱ��ͨ��һ�Թ��õ��Ӷ��γɻ�����HX���ʴ�Ϊ��±��ԭ�ӵ���������������7��
(5). ƽ�ⳣ��Խ��˵����ӦԽ���У�F. Cl��Br��I�ĵõ����������μ�С����Ҫԭ���ǣ�ͬһ����Ԫ�ش�������ԭ�Ӻ�����Ӳ����������࣬ԭ�Ӱ뾶�����õ�������������ɵģ��ʴ�Ϊ��ͬһ����Ԫ�ش�������ԭ�Ӻ�����Ӳ�������������
(6). a. KֵԽ��˵����Ӧ������̶�Խ��ת����Խ�ߣ���a��ȷ��b. ��Ӧ������̶�ԽС��˵��������Խ���ȶ�����b��ȷ����ѡ��c��d����K�Ĵ�С��ֱ�ӹ�ϵ����c��d����ѡab��
(7). ��ͬ±��ԭ��֮����γ�±�ػ������������±�ص�������������������������Ӧ����HCl�������ԭ�������ƶ�BrCl��SO2��ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ��BrCl+SO2+2H2O=H2SO4+HCl+HBr���ʴ�Ϊ��BrCl+SO2+2H2O=H2SO4+HCl+HBr��
�����͡�������
��������
16
����Ŀ��CH4��������CO2�����ɵõ�����CO�����壬�����������ֻ�����Ʒ���ü����еĻ�ѧ��ӦΪ��CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ��H=+330kJ/mol
2H2O(g)+4CO(g) ��H=+330kJ/mol
��1����ͼ��ʾ��ʼͶ�ϱ�n(CH4):n(CO2)Ϊ1:3��1:4��CH4��ת�����ڲ�ͬ�¶ȣ�T1��T2������ѹǿ�Ĺ�ϵ��[ע��Ͷ�ϱ���a1��a2��ʾ]
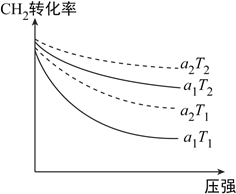
��a2=__________��
���ж�T1��T2�Ĵ�С��ϵ����˵�����ɣ�__________��
��2��CH4��������CO2�Ĵ�ת��ԭ��ʾ��ͼ���£�

�ٹ��̢�����1mol H2ʱ����123.5kJ���������Ȼ�ѧ����ʽ��__________��
�ڹ��̢�ʵ���˺��������뺬̼���ֵķ��롣����H2O(g)�Ļ�ѧ����ʽ��__________��
�ۼ�����̢���̢��еĸ�����ת����ȫ������˵����ȷ����__________��������ţ�
a�����̢���̢��з�����������ԭ��Ӧ
b�����̢���ʹ�õĴ���ΪFe3O4��CaCO3
c�������̢�Ͷ��![]() ���ɵ��¹��̢��д���ʧЧ
���ɵ��¹��̢��д���ʧЧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������̲����ǻ��ԺõĴ�����Ҳ���㷺�����ɵ�ص��������ϡ�ij��ѧС������ø����̿���Ҫ�ɷ�Ϊ�̵Ļ��������������Ϊԭ����ȡ�������̵Ĺ���������ͼ��
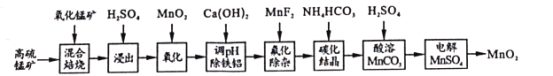
��֪��������ϱ��������������MnSO4��Fe2O3������FeO��MgO��Al2O3
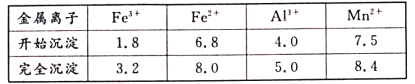
���ڸ������£��������ӿ�ʼ��������ȫ������pH���±���
��1��д������ʱ����Ԫ���йص����ӷ�Ӧ����ʽ__��
��2�������������������Ƿ��ʡ��__�������������������������������__��
��3������pH����������ʱ�����ɳ�����pH��ΧΪ__���������������г�ȥ������Ϊ__��
��4������ƽ���ƶ�ԭ�����ͳ��Ӵ������Mn2+��NH4HCO3ת����MnCO3�����Ĺ���__�������ֺ����ӷ���ʽ�����
��5���ö��Ե缫���MnSO4�Ʊ�MnO2ʱ����������ӦʽΪ__�������������ܹ�ѭ�����õ����ʳ�MnO2���__��д���ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ����ͼ��ʾN2O��Pt2O+������CO��Ӧת����������Ĺ��̡�����˵����ȷ����
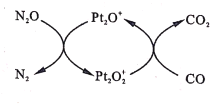
A.N2Oת����������ʱ�Ĵ�����Pt2O2+
B.ÿ1mol Pt2O+ת��ΪPt2O2+�õ�����Ϊ3NA
C.�����ɵ�CO2ͨ�˺�����SiO32-��Na+��Cl-����Һ�У�����������
D.1g CO2 ��N2O�Ļ�������к��е�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ��(��I��ʽ����)��ʵ��������ȡ����������£�

��1��ʵ���������������________��������Ҫ��������Ϊ________��
��2����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���________(�����)��
A���ƾ�(�е�78 ��) B�����Ȼ�̼(�е�77 ��)
C������(�е�290 ��) D����(�е�80 ��)
��3���ڲ������У���Һ����������ICl(ICl����������������)��Ϊ���������ʣ�ʹ��ȫ�����������Ӧ��������________(�����)��Һ����Ӧ�����ӷ���ʽ___________________��
A��KIO3 B��HClO C��KI D��Br2
��4�����õ���л���Һ�õ�����I2�ķ�����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ָ��ͼ�е����ԵĴ���_____������һ������

(2)ʵ��ʱA�г����뺣ˮ�⣬�������_____����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����agij���������������г��ȼ���ٽ�����������ͨ��������Na2O2��ַ�Ӧ����������Ϊbg����a<b��������ʿ����ǣ� ��
A. H2B. COC. ����(CH3COOH)D. ����(CH4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽���ڳ��������������������Ȼ�茶��巴Ӧ�����������仯��ʵ�鷽����ʵ�鲽����ͼ��ʾ�����������ʵ�鷽���Ͳ���ش��������⣺
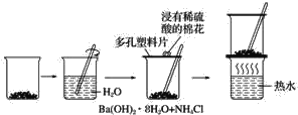
�±���ijѧ����������ʵ�鷽���Ͳ����б�������ʵ����ʵ�ͽ��ۣ�
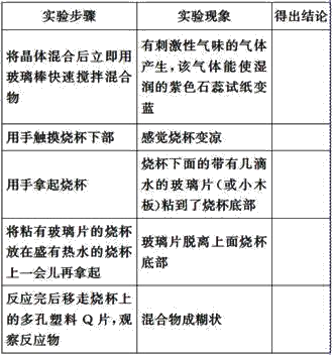
(1)�������ʵ������ó���Ӧ��ʵ����������ϱ��С�_________________��
(2)�û�ѧ����ʽ��ʾ������ӦΪ_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com