
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质转移到MnO2晶格中生成LiMnO2。请回答下列问题:
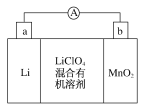
(1)外电路的电流方向是由___极流向___极(填字母)。
(2)负极的电极反应式为___。
(3)是否可用水代替电池中的混合有机溶剂___(填“是”或“否”);原因是___。
【答案】b a Li-e-=Li+ 否 电极Li是活泼金属,能与水反应
【解析】
形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题。
(1)该电池中Li失去电子生成Li+,所以Li作电池的负极,则a是负极,b是正极,所以外电路中的电流方向由正极流向负极,所以从b流向a。
(2)负极发生氧化反应,即Li失去电子生成Li+,电极反应式为Li-e-=Li+。
(3)不能用水代替电池中的混合有机溶剂,因为Li是活泼金属,与水反应,无法参与原电池反应,不能产生电流。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )
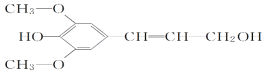
A. 芥子醇的分子式是C11H14O4,属于芳香烃
B. 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2
C. 芥子醇不能与FeCl3溶液发生显色反应
D. 芥子醇能发生的反应类型有氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】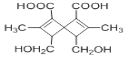 是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
A.该有机物在一定条件下能发生酯化反应、还原反应、氧化反应、加成反应、消去反应
B.该有机物中有4种官能团
C.1mol该有机物分别与足量的碳酸氢钠溶液、金属钠反应,产生气体的物质的量不相同
D.该有机物的分子式为C14H16O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是

A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
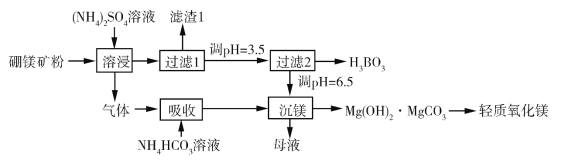
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中说明2HI(g)H2(g)+I2(g)已达平衡状态的是__________
①单位时间内生成nmolH2的同时,生成nmolHI;
②1个H﹣H键断裂的同时有2个H﹣I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI):c(H2):c(I2)=2:1:1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
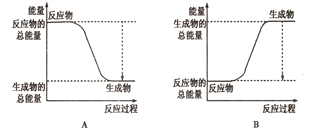
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
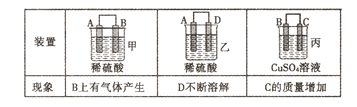
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com