
【题目】下列情况中说明2HI(g)H2(g)+I2(g)已达平衡状态的是__________
①单位时间内生成nmolH2的同时,生成nmolHI;
②1个H﹣H键断裂的同时有2个H﹣I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI):c(H2):c(I2)=2:1:1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是___________。
【答案】②⑥⑨ ⑥⑦⑧⑨⑩
【解析】
①单位时间内生成nmolH2的同时,生成nmolHI,变化量之比不等于计量数之比,故错误;
②1个H﹣H键断裂,等效于2个H﹣I键形成,同时有2个H﹣I键断裂,正逆反应速率相等,达平衡状态,故正确;
③各组分百分含量不变是平衡状态的特征,而平衡时混合气中百分组成可能为HI%=I2%,与各物质的初始浓度及转化率有关,故错误;
④只要反应发生就有反应速率v(H2)=v(I2)=![]() v(HI),故错误;
v(HI),故错误;
⑤当体系达平衡状态时,混合气体中c(HI):c(H2):c(I2)可能是2:1:1,也可能不是,与各物质的初始浓度及转化率有关,故错误;
⑥温度和体积一定时,某一生成物浓度不再变化,正逆速率相等达平衡状态,故正确;
⑦温度和体积一定时,两边计量数相等,容器内压强始终不再变化,故错误;
⑧条件一定,两边计量数相等,混合气体的平均分子质量始终不再变化,故错误;
⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,反应达平衡状态,故正确;
⑩温度和压强一定时,两边气体的计量数相等,体积是一个定值,混合气体的密度始终不再变化,故错误;故选②⑥⑨。
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是:
⑥温度和体积一定时,某一生成物浓度不再变化,正逆速率相等达平衡状态,故正确;
⑦温度和体积一定时,两边计量数不相等,容器内压强不再变化,说明反应达平衡状态,故正确;
⑧条件一定,混合气体的平均分子质量不再变化,说明物质的量不变,反应达平衡状态,故正确;
⑨温度和体积一定时,混合气体的颜色不再变化,说明二氧化氮的浓度不变,反应达平衡状态,故正确;
⑩温度和压强一定时,混合气体的密度不再变化,说明气体的物质的量不变,反应达平衡状态,故正确;
故选⑥⑦⑧⑨⑩。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
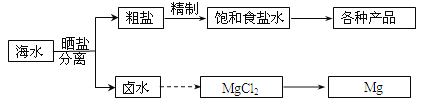
【题目】海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl26H2O;
d.将MgCl26H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,h的组成元素位于同一主族。上述物质的转化关系如图所示。下列说法正确的是
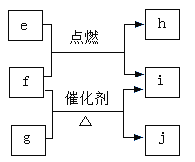
A.原子半径:Y>Z>W>XB.热稳定性:i>g, 沸点:i>e
C.Y与W的含氧酸均是强酸D.h与j均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
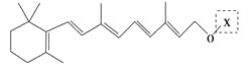
为了研究X的结构,将化合物A在一定条件下水解只得到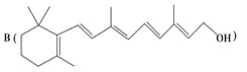 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
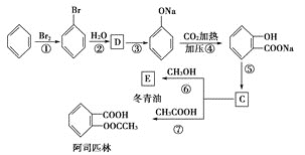
(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质转移到MnO2晶格中生成LiMnO2。请回答下列问题:
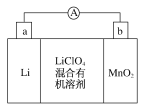
(1)外电路的电流方向是由___极流向___极(填字母)。
(2)负极的电极反应式为___。
(3)是否可用水代替电池中的混合有机溶剂___(填“是”或“否”);原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
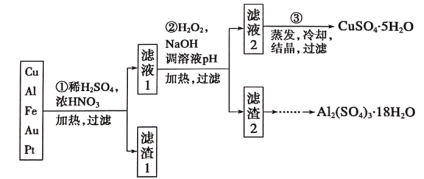
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________;
得到滤渣I的主要成分为____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
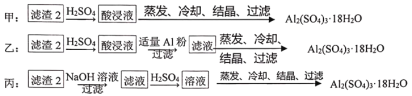
上述三种方案中,___方案不可行,原因是_____;从原子利用率角度考虑,___方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com