
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
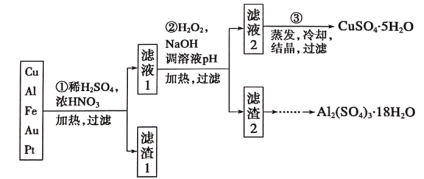
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________;
得到滤渣I的主要成分为____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
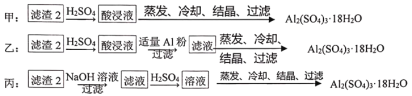
上述三种方案中,___方案不可行,原因是_____;从原子利用率角度考虑,___方案更合理。
【答案】Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O Au、Pt 将Fe2+氧化为Fe3+,不引入杂质,对环境无污染 加热脱水 甲 所得产品中含有较多Fe2(SO4)3杂质 乙
3Cu2++2NO↑+4H2O Au、Pt 将Fe2+氧化为Fe3+,不引入杂质,对环境无污染 加热脱水 甲 所得产品中含有较多Fe2(SO4)3杂质 乙
【解析】
本题是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物为原料,制备硫酸铜和硫酸铝晶体,涉及了用离子方程式表示反应原理,利用绿色氧化剂过氧化氢氧化二价亚铁离子得到三价铁离子,然后通过调整溶液的pH使Fe3+、Al3+沉淀,再先用碱溶液溶解沉淀,过滤后再用酸溶解沉淀,得到的溶液再分别结晶,根据物质中杂质含量判断方案的可行性,根据原子利用率高低判断方案的优劣。
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,其中不活泼的金属Au、Pt不能溶解,进入滤渣;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与硝酸反应的离子方程式为:Cu+4H++2NO3-![]() Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O;
3Cu2++2NO↑+4H2O;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;H2O2作氧化剂,还原产物是H2O,不引入杂质,对环境无污染;
(3)由于CuSO4是难挥发性的强酸生成的盐,在加热过程中发生水解反应产生的Cu(OH)2与硫酸会再反应产生CuSO4,所以第③步由CuSO4·5H2O制备CuSO4的方法应是直接在坩埚中加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中:
甲方案在滤渣中只加了硫酸,会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法甲不可行;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加适量Al粉,Al和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,乙方案可行;
丙方案先在滤渣中加NaOH,NaOH和Al(OH)3反应生成可溶性的NaAlO2,然后在滤液中加H2SO4,NaAlO2与硫酸反应生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,方案丙可行;
可见在上述三种方案中,方案甲不可行,方案乙、丙可行,甲方案不可行原因是所得产品中含有较多Fe2(SO4)3杂质;
从原子利用率角度考虑,方案乙反应步骤少,产生的副产物少,原子利用率相对高些,所以方案乙更合理。


科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高的药用价值的绿原酸(如图),下列说法错误的是

A.1 mol绿原酸与足量溴水反应,最多消耗4 mol Br2
B.绿原酸能发生取代、加成、消去和氧化反应
C.1 mol绿原酸与足量Na反应生成气体在标况下的体积为33.6L
D.绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中说明2HI(g)H2(g)+I2(g)已达平衡状态的是__________
①单位时间内生成nmolH2的同时,生成nmolHI;
②1个H﹣H键断裂的同时有2个H﹣I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI):c(H2):c(I2)=2:1:1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
上述⑥~⑩的说法中能说明2NO2N2O4达到平衡状态的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
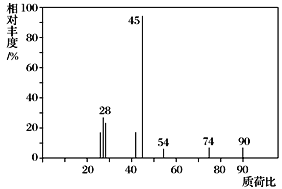
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
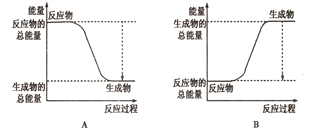
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
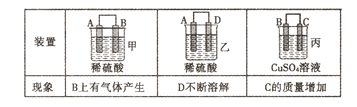
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH4+与H3O+中心原子的价层电子对数相同
B.BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同
C.金属Zn晶体中的原子堆积方式为六方堆积
D.HOCH2CH(OH)CH2OH和(CH3)2CClCH2CH3都是手性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______,1mol草酸分子中含有σ键的数目为______。
(3)与SiF4互为等电子体的阴离子的化学式为______。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______。
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______。
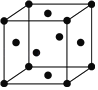
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
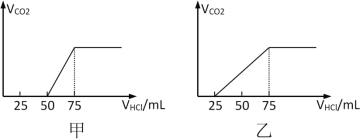
试分析NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?__________产生的CO2气体体积(标况)是多少?____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com