
【题目】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______,1mol草酸分子中含有σ键的数目为______。
(3)与SiF4互为等电子体的阴离子的化学式为______。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______。
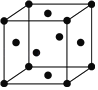
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______。
【答案】1s22s22p63s23p63d4 sp2杂化 7NA SO42- CH3COOH可与H2O形成氢键 12
【解析】
(1)Mn是25号原子,Mn原子失去3个电子生成Mn3+,根据构造原理书写Mn3+基态核外电子排布式为1s22s22p63s23p63d4;
(2)草酸分子中C原子价层电子对个数是3,根据构造原理书写C原子轨道杂化类型为sp2;一个草酸分子中含有7个σ键,则1mol草酸中含有σ键的数目为7×6.02×1023;
(3)与SiF4互为等电子体的阴离子中含有5个原子且价电子数是32,所以与其互为等电子体的阴离子有SO42-、PO43-等;
(4)溶质分子和水分子之间形成氢键时能增大溶质的溶解度,乙酸与水分子间可形成氢键而导致乙酸易溶于水;
(5)Mn为面心立方最密堆积,每个Mn原子距离最近的Mn原子个数=3×8×![]() =12。
=12。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,e、g、h、i、j均是由这些元素组成的二元化合物,i常温常压下为液体,其余均为无色气体。e的摩尔质量为g的2倍,f是元素Z的单质,g物质能使湿润的红色石蕊试纸变蓝,h的组成元素位于同一主族。上述物质的转化关系如图所示。下列说法正确的是
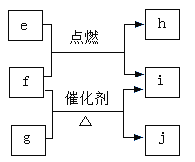
A.原子半径:Y>Z>W>XB.热稳定性:i>g, 沸点:i>e
C.Y与W的含氧酸均是强酸D.h与j均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
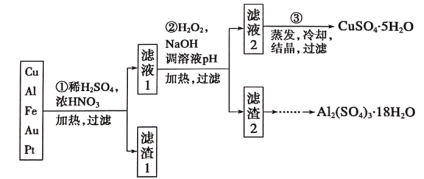
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________;
得到滤渣I的主要成分为____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
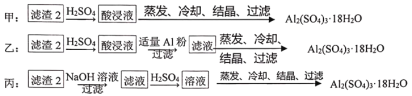
上述三种方案中,___方案不可行,原因是_____;从原子利用率角度考虑,___方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡萝卜中具有较多的胡萝卜素,它是人体主要营养之一,α-胡萝卜素的结构为: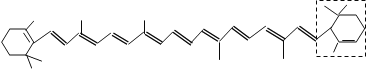 。有机化学中有时可以将结构简式中的C和H省略不写,如
。有机化学中有时可以将结构简式中的C和H省略不写,如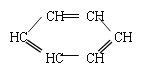 可写为:
可写为:![]() ;又如
;又如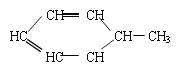 可写为:
可写为:![]() 。
。
(1)写出α-胡萝卜素的化学式______________。
(2)1mol胡萝卜素最多能与__________molBr2发生加成反应。
(3)β-胡萝卜素与α-胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳架结构相同,写出β-胡萝卜素虚线框内可能的结构简式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com