
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
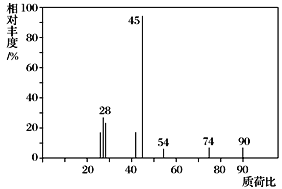
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
【答案】90 C3H6O3 羧基 ![]() 2.24
2.24
【解析】
(1)有机物质谱图中,最右边的峰表示有机物的相对分子质量;浓H2SO4吸水,计算氢的物质的量;碱石灰吸收CO2,计算碳的物质的量;根据有机物总质量、碳、氢的质量,计算氧原子的物质的量,得出有机物的实验式;根据相对分子质量,得出C的分子式;
(2)C能与NaHCO3溶液发生反应,则C中含有官能团羧基。
(3)根据氢原子的种类及个数之比可知,确定C的结构简式;
(4)C中含有1个羟基和1个羧基,所以0.1 mol C与Na反应能生成0.1 mol H2。
(1)有机物质谱图中,最右边的峰表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中氧原子的物质的量是=![]() 0.3 mol,所以此有机物的实验式为CH2O,又因其相对分子质量为90,所以C的分子式为C3H6O3。
0.3 mol,所以此有机物的实验式为CH2O,又因其相对分子质量为90,所以C的分子式为C3H6O3。
答案: 90 C3H6O3
(2)C能与NaHCO3溶液发生反应,则C中含有官能团羧基;
答案:羧基
(3)根据氢原子的种类及个数之比可知,C的结构简式为![]() ;
;
答案:![]()
(4)C中含有1个羟基和1个羧基,所以0.1 mol C与Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
答案:2.24


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】40 ℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
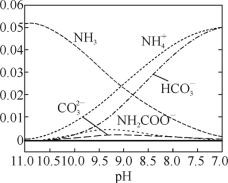
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 随着CO2的通入,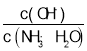 不断增大
不断增大
C. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为 _________________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是______________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________________。
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为____________________。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为________g·cm-3。
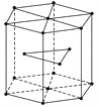
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电的本质是阴阳离子在电场作用下迁移,通过实验探究同一溶液中不同离子的迁移差异。将pH试纸用不同浓度Na2SO4的溶液充分浸湿,进行如下实验:
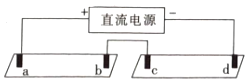
a,b,c,d均是石墨电极,电极间距4cm,电极电流0.20mA。实验现象:
时间 | 试纸Ⅰ | 试纸Ⅱ |
1min | a极试纸附近变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
对实验现象解释及预测不合理的是( )
A.b、d两极附近变蓝的原因:2H2O+2e-=H2↑+2OH-
B.试纸Ⅰ红色区长度大于蓝色区:说明单位时间内OH-的迁移速度快于H+
C.试纸Ⅱ中的现象说明此浓度下迁移的主要离子是Na+和SO42-
D.预测10min后,试纸Ⅰ红蓝区之间又会出现黄色区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲证明乙炔能与KMnO4酸性溶液反应,实验方案如下:将电石与水反应生成的气体通入KMnO4酸性溶液,溶液褪色,证明二者发生了反应。请回答:
(1)制备乙炔的反应的化学方程式是_______。
(2)该同学的实验方案存在的问题是______。
(3)为了解决上述问题,需重新选择实验装置,备选装置如图所示。
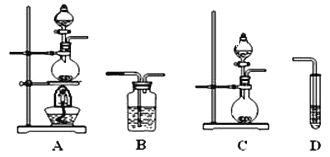
①将装置编号按顺序填在横线上___→B→__________。
②B装置中所盛放的试剂是____________。
(4)乙炔使酸性KMnO4溶液褪色的离子方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com