
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
【答案】D
【解析】
A.8.7gMnO2的物质的量为0.1mol,40mL10mol·L-1的浓盐酸物质的量为0.4mol,若浓盐酸完全反应生成的氯气为0.1mol,氯气分子数目为0.1NA个,但二氧化锰只能与浓盐酸反应,和稀盐酸不反应,随着反应的进行,浓盐酸变为稀盐酸,不能反应完全,则生成的氯气分子小于0.1NA个,故A正确;
B.MgO和Mg3N2中镁元素的化合价都是+2价,0.1mol镁完全反应失去0.2mol电子,转移的电子数为0.2NA,故B正确;
C.一个H2O2分子中含有18个电子,1.7gH2O2的物质的量为![]() =0.05mol,则含有的电子数为18×0.05×NA=0.9NA,故C正确;
=0.05mol,则含有的电子数为18×0.05×NA=0.9NA,故C正确;
D.一个丙烷分子中含有含有10个共价键,44g丙烷的物质的量为![]() =1mol,则含有共价键的数目为1 ×10×NA=10NA,故D错误;
=1mol,则含有共价键的数目为1 ×10×NA=10NA,故D错误;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
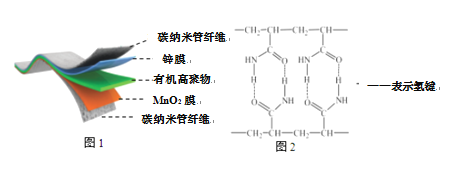
下列说法中,正确的是
A.充电时,含有锌膜的碳纳米管纤维一端连接电源正极
B.放电时,电池的正极反应为:MnO2+e+H+==MnOOH
C.充电时,Zn2+移向Zn膜
D.合成有机高聚物的单体之一是:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
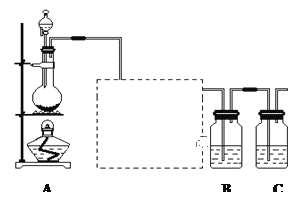
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的原子半径是同周期中最小的。下列判断错误的是( )
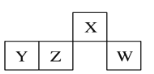
A.原子半径:rY>rZ>rWB.X、Y两元素形成化合物是酸性氧化物
C.最简单气态氢化物的热稳定性:Z>WD.X、Z两元素形成一种化合物可作干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中不正确的是( )
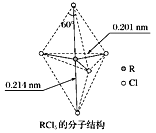
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D. 分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_____。
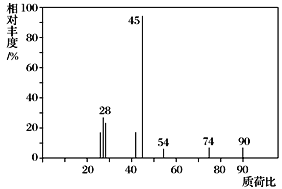
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是__________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有CO32-、SO42-、SO32-、Fe2+、Fe3+、NH4+、Ba2+中的三种离子,实验小组为确定其化学式做了如下实验:
①准确称取6.125g样品,配制成250.00mL溶液X。
②取20.00mL溶液X,加入足量盐酸,无明显现象;再加足量BaCl2溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体0.5825g。
③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL。
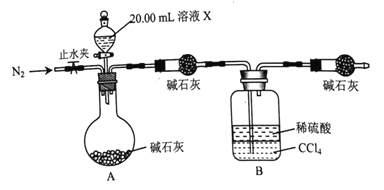
④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g。
⑤取少量溶液X,滴加0.1 mol ·L-1 KSCN溶液无明显现象,再向其中滴加0.1mol·L-1AgNO3溶液,有白色沉淀生成。
回答下列问题;
(1)完成实验①所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________________。
(2)实验③达到滴定终点的现象是________________________________________。
(3)实验④的反应结束后,打开止水夹通入N2的作用是_________________________。
(4)根据以上实验数据计算该结晶水合物的化学式为_________________________。
(5)某同学查阅资料发现 AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了如图实验装置并进行下列实验。
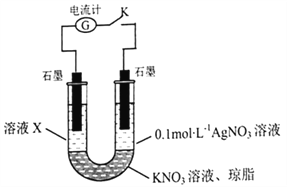
先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________(用离子方程式表示),该实验设计的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,含氮元素的物质可发生如图所示的循环转化。

回答下列问题:
(1)氮的原子结构示意图为_________。
(2)图中属于“氮的固定”的是_________(填字母,下同);转化过程中发生非氧化还原反应的是_________。
(3)若“反应h”是在NO2与H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_________。
(4)若“反应i”是在酸性条件下由NO3-与Zn的作用实现,则该反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com