
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中不正确的是( )
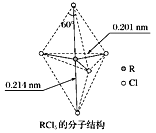
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D. 分子中5个R—Cl键键能不都相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A. 图 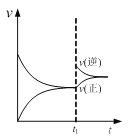 可表示N2+3H2
可表示N2+3H2![]() 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
B. 图 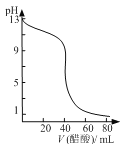 可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
C. 图 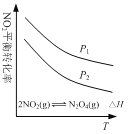 可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D. 图 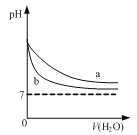 可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
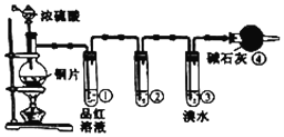
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。若准确称取0.44g某有机物样品,经充分燃烧后,依次通入浓硫酸和碱石灰,分别增重0.36g、0.88g.
(1)求该有机物的实验式为___________
(2)已知其蒸气密度为同条件下H2的22倍,该有机物的分子式为___________
(3)该有机物的核磁共振氢谱中有2个峰,峰面积之比为1:3,其结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
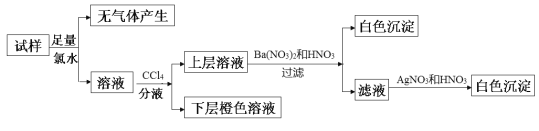
则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电的本质是阴阳离子在电场作用下迁移,通过实验探究同一溶液中不同离子的迁移差异。将pH试纸用不同浓度Na2SO4的溶液充分浸湿,进行如下实验:
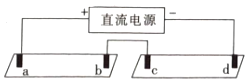
a,b,c,d均是石墨电极,电极间距4cm,电极电流0.20mA。实验现象:
时间 | 试纸Ⅰ | 试纸Ⅱ |
1min | a极试纸附近变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
对实验现象解释及预测不合理的是( )
A.b、d两极附近变蓝的原因:2H2O+2e-=H2↑+2OH-
B.试纸Ⅰ红色区长度大于蓝色区:说明单位时间内OH-的迁移速度快于H+
C.试纸Ⅱ中的现象说明此浓度下迁移的主要离子是Na+和SO42-
D.预测10min后,试纸Ⅰ红蓝区之间又会出现黄色区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。

(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6 g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2 g,则混合气中CO的质量为( )。
A. 24.4 gB. 13.2 gC. 12.5 gD. 11.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com