
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
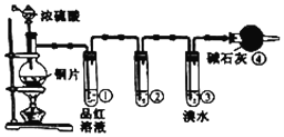
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
【答案】分液漏斗 吸收尾气,防止污染环境 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O b A
CuSO4+SO2↑+2H2O b A
【解析】
铜和浓硫酸反应生成SO2,SO2具有漂白性,能够使品红溶液褪色;SO2能与I2反应,化合价升高生成H2SO4,利用碱石灰,吸收SO2。
(1)图中仪器a的名称为分液漏斗;装置④中为碱石灰,能够吸收SO2,防止污染环境,因此其作用是吸收尾气,防止污染环境;
(2)铜片与浓H2SO4共热发生反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)为了验证SO2是酸性氧化物,SO2与水反应生成H2SO3,能够使紫色石蕊试液变红;SO2能使酸性KMnO4溶液褪色,体现SO2的还原性;SO2与Na2S反应生成S单质,体现SO2的氧化性,故答案为:b;
(4)A.反应生成气体,则先检査装置的气密性,再向装置中加入药品,故A正确;
B.实验开始时,只需打开分液漏斗的旋塞,还需要打开上部的塞子,利用压强使液体顺利滴下,故B错误;
C.实验开始后,试管①和③溶液均褪色,前者证明SO2具有漂白性,后者证明其还原性,故C错误;
答案为A。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】制备氢氧化铁胶体以及在胶体中滴加适量HI溶液,其过程如下图所示,下列说法错误的是
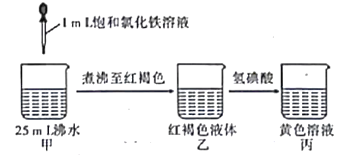
A.氢氧化铁胶体带正电荷,能聚沉水中带负电荷的杂质
B.乙转化为丙过程中发生聚沉、复分解反应、氧化还原反应
C.利用丁达尔效应可验证乙中是否生成了胶体
D.煮沸的目的是促进Fe3+水解生成更多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成CO和液态水时放出38kJ热量,则该条件下反应2CH4(g)+3O2(g) =2CO(g)+4H2O(l)的ΔH=___。
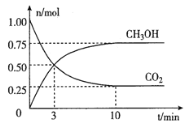
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=___。
②达到平衡时,H2的转化率为___。
(3)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和否H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
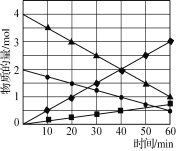
(4)从烟道气中回收硫是有效处理SO2大气污染的有效方法之一,该方法是在催化剂、773K条件下,CO与SO2反应生成CO2和硫蒸气,该反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:___。
(5)近几年来关于氮污染的治理倍受关注。向工业废水中加入次氯酸钠溶液,可将其中的NH4+完全转化为N2,而次氯酸钠被还原为NaCl。写出上述反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )

A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
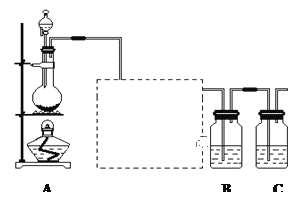
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中不正确的是( )
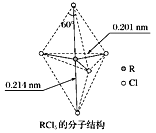
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D. 分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的有
A.向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:
Ca2++2ClO- +2H2O+2SO2= CaSO4↓+2Cl- +4H++SO42-
B.向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-![]() SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+ OH-![]() H2O +CO32-
H2O +CO32-
D.用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com