
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。
【答案】NiO2 负 正 过滤 将Fe2+氧化为Fe3+ 不正确 同时会使Cu2+生成沉淀而除去 Fe(OH)2+2e-= Fe+2OH-
【解析】
(1) 某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,该蓄电池放电时,NiO2中Ni元素的化合价降低,发生还原反应;
Fe(OH)2+Ni(OH)2,该蓄电池放电时,NiO2中Ni元素的化合价降低,发生还原反应;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,采用牺牲阳极的阴极保护法,也可以采用外加电源的阴极保护法;
(3)精炼粗铜时,粗铜作阳极、纯铜作阴极;①根据除杂方案,操作I是将沉淀从溶液中除去;精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,据此分析加入双氧水的目的;②当溶液的pH=8时,结合表格数据分析解答;
(4) 蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,据此书写电极反应式。
Fe(OH)2+Ni(OH)2,充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,据此书写电极反应式。
(1) 某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,该蓄电池放电时,NiO2中Ni元素的化合价降低,发生还原反应,故答案为:NiO2;
Fe(OH)2+Ni(OH)2,该蓄电池放电时,NiO2中Ni元素的化合价降低,发生还原反应,故答案为:NiO2;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,采用牺牲阳极的阴极保护法,也可以与该蓄电池的负极相连,采用外加电源的阴极保护法,故答案为:负;
(3)精炼粗铜时,粗铜作阳极、纯铜作阴极,所以粗铜与电源正极相连,故答案为:正;
①根据除杂方案,操作I是将沉淀从溶液中除去,因此操作I为过滤;精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,便于除去杂质离子,使精炼粗铜正常进行,故答案为:过滤;将Fe2+氧化为Fe3+;
②当溶液的pH=8时,铜离子能生成沉淀而被除去,影响了精炼粗铜的电解实验,故答案为:不正确;同时会使Cu2+生成沉淀而除去;
(4) 蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,电极反应式为Fe(OH)2+2e-= Fe+2OH-,故答案为:Fe(OH)2+2e-= Fe+2OH-。
Fe(OH)2+Ni(OH)2,充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,电极反应式为Fe(OH)2+2e-= Fe+2OH-,故答案为:Fe(OH)2+2e-= Fe+2OH-。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C. 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
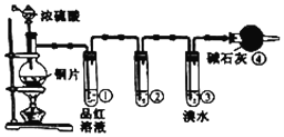
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。若准确称取0.44g某有机物样品,经充分燃烧后,依次通入浓硫酸和碱石灰,分别增重0.36g、0.88g.
(1)求该有机物的实验式为___________
(2)已知其蒸气密度为同条件下H2的22倍,该有机物的分子式为___________
(3)该有机物的核磁共振氢谱中有2个峰,峰面积之比为1:3,其结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电的本质是阴阳离子在电场作用下迁移,通过实验探究同一溶液中不同离子的迁移差异。将pH试纸用不同浓度Na2SO4的溶液充分浸湿,进行如下实验:
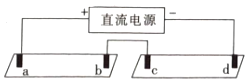
a,b,c,d均是石墨电极,电极间距4cm,电极电流0.20mA。实验现象:
时间 | 试纸Ⅰ | 试纸Ⅱ |
1min | a极试纸附近变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
对实验现象解释及预测不合理的是( )
A.b、d两极附近变蓝的原因:2H2O+2e-=H2↑+2OH-
B.试纸Ⅰ红色区长度大于蓝色区:说明单位时间内OH-的迁移速度快于H+
C.试纸Ⅱ中的现象说明此浓度下迁移的主要离子是Na+和SO42-
D.预测10min后,试纸Ⅰ红蓝区之间又会出现黄色区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”),Ts的原子核外最外层电子数是7。下列叙述不正确的是
”),Ts的原子核外最外层电子数是7。下列叙述不正确的是
A.Ts是第七周期第ⅥIA族元素
B.Ts的同位素原子具有相同的电子数
C.HTs易溶于水,稳定性强,还原性强
D.Ts在同族元素中非金属性最弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com