
【题目】制备氢氧化铁胶体以及在胶体中滴加适量HI溶液,其过程如下图所示,下列说法错误的是
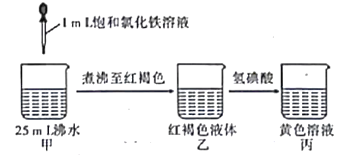
A.氢氧化铁胶体带正电荷,能聚沉水中带负电荷的杂质
B.乙转化为丙过程中发生聚沉、复分解反应、氧化还原反应
C.利用丁达尔效应可验证乙中是否生成了胶体
D.煮沸的目的是促进Fe3+水解生成更多的Fe(OH)3
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
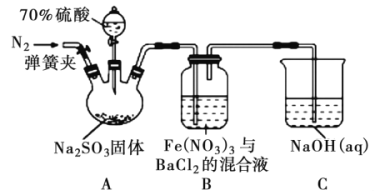
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、X为周期表前四周期的元素,A→F原子序数依次增大。A位于第一周期,B原子有3个不同的能级,各能级的电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的电子层结构;F元素有“生物金属”之称,F4+离子和氩原子核外电子排布相同;X是第三周期电负性最大的元素。回答下列问题:
(1)F基态原子的核外电子排布式______________ ,用过量的E粉与 FX4高温条件下反应生成金属F,该化学方程式为___________________。
(2)在A与上述元素形成的分子中,中心原子采取sp3杂化的是________________(写出两种)。
(3)下图是BD2分子的晶胞模型,图中显示出的BD2分子数为14个。实际上一个BD2晶胞中含有__________个BD2分子。
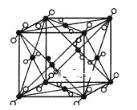
![]() 代表一个BD2分子
代表一个BD2分子
(4)B元素可形成B60单质,从晶体类型来看B60属于__________晶体。科学家把B60与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图(白球(C60)位于立方体的体心和顶点,小黑球(K)则位于立方体的面上),该化合物中B60与钾原子个数比为________________。
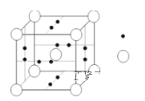
(5)已知单晶锗、晶体硅与金刚石的晶体类型完全相同,下图所示是金刚石的晶胞结构,请回答:
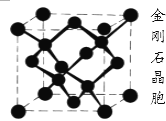
在单晶锗的一个晶胞内含有__________个锗原子。
(6)若向CuSO4溶液中加入少量氨水生成蓝色絮状沉淀,继续加入过量氨水沉淀溶解,得到深蓝色的透明溶液,最后向该溶液中加入一定量的乙醇,所析出晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列选项中互为同系物的是__________;互为同分异构体的是__________;属于同种物质的是__________。
①H2O与D2O;②1H、2H、3H;③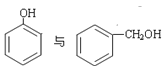 ;④
;④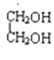 与
与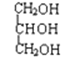 ;⑤
;⑤ ![]() ;⑥戊烯与环戊烷; ⑦
;⑥戊烯与环戊烷; ⑦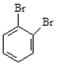 与
与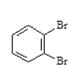
(2)羟基、羧基的性质具有明显的差异,为实现如图所示的各步转化,请在括号内填入适当试剂的化学式。
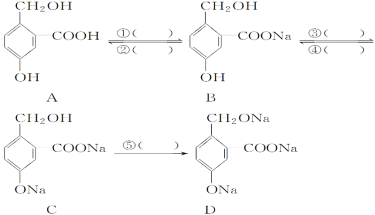
①__________;②__________;③__________;④__________;⑤__________;
(3)聚碳酸酯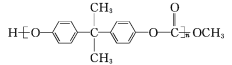 的透光率良好,可制作车、船、飞机的挡风玻璃等。①原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯(
的透光率良好,可制作车、船、飞机的挡风玻璃等。①原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯(![]() )与____(填序号)缩合聚合而成。
)与____(填序号)缩合聚合而成。
A.二卤代物 B.二酚类 C.二醛类 D.二烯类
②写出用绿色化学原料合成聚碳酸酯反应的化学方程式____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)近年来,人类生产、生活所产生的污染物,使雾霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是_____________
A.灰霾属于纯净物 B.雾霾天气,儿童、老年人应减少户外活动
C.灰霾能发生丁达尔现象 D.减少燃煤用量能降低灰霾天气的产生频率
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统。雾丁达尔效应与水蒸汽有关,欲在树林中观察到丁达尔现象,你认为一天中最有可能观察到该现象的时间是____________,理由是___________________________________________________________
(3)为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2。该技术的工作原理是使烟气中的SO2与浆液中的石灰石以及鼓入的空气反应生成生石膏(CaSO4·2H2O)。
①写出该工艺的化学方程式:______________________________________;该反应中每消耗标况下11.2L SO2,转移电子的物质的量为_____________
②若燃煤的含硫量(硫单质)为4%,燃烧1吨该燃煤生成的SO2有96%转化为生石膏,然后经过加热脱水形成熟石膏(2CaSO4·H2O),则可获得熟石膏_____________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A. 图 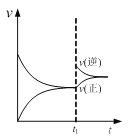 可表示N2+3H2
可表示N2+3H2![]() 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
B. 图 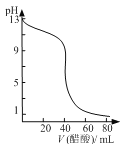 可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
可表示用0.1000 mol·L-1醋酸滴定40.00mL 0.1000mol·L-1NaOH溶液得到的滴定曲线
C. 图 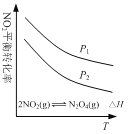 可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D. 图 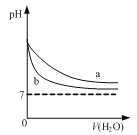 可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
可表示pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线a对应氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
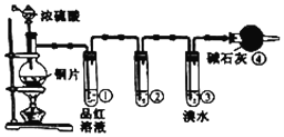
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com