
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
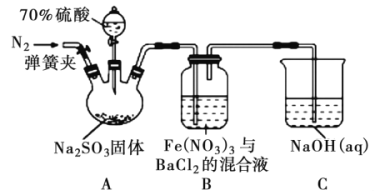
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
【答案】A
【解析】
A. 装置A中70%的硫酸与亚硫酸钠反应放出二氧化硫,二氧化硫的水溶液显酸性,在酸性条件下,NO3-能够氧化二氧化硫生成SO42-,从而在B中产生硫酸钡白色沉淀,不能说明Fe3+能将SO2氧化成SO42-,故A错误;
B. 实验室中配制70%的硫酸,需要用量筒量取适当体积的浓硫酸,然后慢慢倒入一定量水中,边倒边搅拌,需要的玻璃仪器有量筒、烧杯、玻璃棒,故B正确;
C. 二氧化硫能够被氧化,为了排除空气中氧气的干扰,在滴加浓硫酸之前,三颈烧瓶中需要通入N2以排尽装置内的空气,故C正确;
D. 二氧化硫在水中的溶解度较大,装置C可能发生倒吸,且气体与液体的反应接触不充分,会导致产生的尾气不能完全吸收,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是 ( )
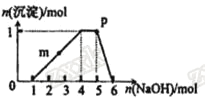
A.m点处反应:H++OH-=H2O
B.p点:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
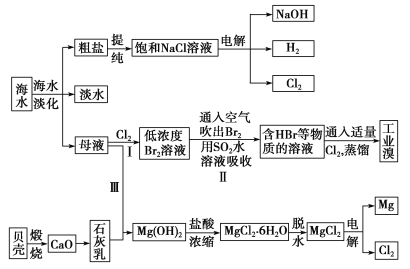
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是________(填编号)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_______________________。
(3)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入MgCl2溶液,充分搅拌后经________(填操作方法)可得纯净的Mg(OH)2。
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填字母)。
A.H2 B.CO2 C.N2 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2 ,下列说法不正确的是

A. 太阳能最终转变为化学能 B. T<1050℃时,CeO2-δ比CeO2稳定
C. CeO2是水分解的催化剂 D. 两步反应均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的A、B、C、D、E、X均为中学化学常见物质。已知A为淡黄色固体,D为白色难溶于水的物质,且A和D的摩尔质量相等,在一定条件下它们有如下转化关系:
![]()
(1)写出A的电子式________。
(2)用离子方程式表示X的水溶液呈酸性的原因________ 。
(3)写出上述转化中C→D对应反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在25 ℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________________________________。
(2)Zn(s) + 1/2 O2(g) = ZnO(s) ΔH1 = -351 kJ/mol Hg(l) + 1/2 O2(g) = HgO(s) ΔH2 = -91 kJ/mol,由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= __________kJ/mol。
Ⅱ、二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡。改变下列条件之一,既能提高反应速率,又能提高CO的转化率的是________(填字母代号)。
a 降低温度 b 加入催化剂 c 缩小容器体积 d 增加H2的浓度
(2)该反应的化学平衡常数表达式K = _______________________,升高温度,平衡常数___________(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3 H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
① 反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”)
② 平衡时,n(CH3OCH3) = ________,平衡时CO2的转化率为________。
③ 平衡时,再向原容器中投入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,一段时间后达到新的平衡,此时CO2的转化率与原平衡相比________(填“增大”、 “减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氢氧化铁胶体以及在胶体中滴加适量HI溶液,其过程如下图所示,下列说法错误的是
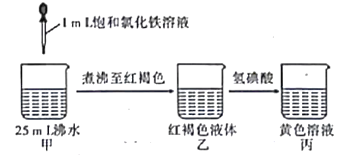
A.氢氧化铁胶体带正电荷,能聚沉水中带负电荷的杂质
B.乙转化为丙过程中发生聚沉、复分解反应、氧化还原反应
C.利用丁达尔效应可验证乙中是否生成了胶体
D.煮沸的目的是促进Fe3+水解生成更多的Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com