
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
【答案】A
【解析】
氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=
n(HCl),所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯离子是可知n(FeCl3)=n(FeCl3)=![]() [n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式。
[n(HCl)+2n(Cl2)],再根据Fe、O原子数目之比确定氧化物化学式。
氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O.由H原子、O原子守恒可知n(O)=n(H2O)=![]() n(HCl)=
n(HCl)=![]() ×0.14L×5mol/L=0.35mol,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯原子是可知n(FeCl3)=
×0.14L×5mol/L=0.35mol,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯原子是可知n(FeCl3)=![]() [n(HCl)+2n(Cl2)]=
[n(HCl)+2n(Cl2)]=![]() ×(0.14L×5mol/L+2×
×(0.14L×5mol/L+2×![]() )=0.25mol,所以氧化物中n(Fe):n(O)=0.25mol:0.35mol=5:7,该氧化物的化学式为Fe5O7,故答案为A。
)=0.25mol,所以氧化物中n(Fe):n(O)=0.25mol:0.35mol=5:7,该氧化物的化学式为Fe5O7,故答案为A。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
B. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C. 18gD2O和H2O的混合物中含有的中子数为9NA
D. 12g石墨烯(单层石墨)中含有六元环个数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。
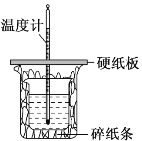
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2在工农业生产过程中有着重要的作用。
I.(1)工业上用电解饱和食盐水的方法制取H2,该反应的离子方程式为___________。
(2)下图是为LiBH4/MgH2体系放氢焓变示意图,
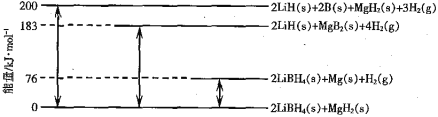
则由LiH、B与H2反应得到LiBH4的热化学方程式为_________。
Ⅱ.高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:Fe+2NaOH+2H2O= Na2FeO4+2H2↑
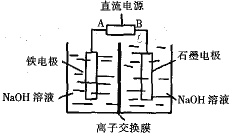
(3)A为电源_______极(填“正”或“负”),铁电极_____(填“能”或“不能”)换成石墨电极。
(4)石墨电极上发生的电极反应式为______。
(5)电解过程中可能存在副产物,左池有时会生成红褐色沉淀,此时只要加大电流强度,就可以使红褐色沉淀继续电解,转化为FeO42-,该过程的电极反应式为____
Ⅲ.(6)利用甲醇燃料电池进行电解的装置如图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后断开K,此时A、B两极上生成等物质的量的气体。
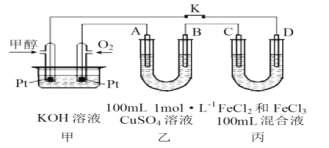
乙中B电极为_____(填“阴极”或“阳极”),该电极上生成的气体在标准状况下的体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
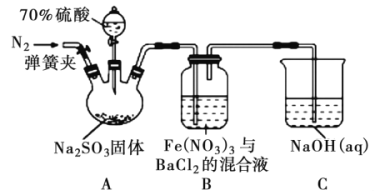
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中,发生反应如下:X(g) + 2Y(g) ![]() W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
A. Y的物质的量浓度B. 混合气体的密度
C. 混合气体的压强D. X的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
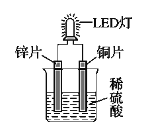
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 铜片上的电极方程式为:2H+ + 2e- = H2↑
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[![]() ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________;CaCN2中阴离子为CN![]() ,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(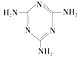 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________,Ca2+采取的堆积方式为____________________________,每个Ca2+周围距离最近且相等的Ca2+有________个。
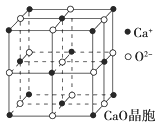
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)近年来,人类生产、生活所产生的污染物,使雾霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是_____________
A.灰霾属于纯净物 B.雾霾天气,儿童、老年人应减少户外活动
C.灰霾能发生丁达尔现象 D.减少燃煤用量能降低灰霾天气的产生频率
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统。雾丁达尔效应与水蒸汽有关,欲在树林中观察到丁达尔现象,你认为一天中最有可能观察到该现象的时间是____________,理由是___________________________________________________________
(3)为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2。该技术的工作原理是使烟气中的SO2与浆液中的石灰石以及鼓入的空气反应生成生石膏(CaSO4·2H2O)。
①写出该工艺的化学方程式:______________________________________;该反应中每消耗标况下11.2L SO2,转移电子的物质的量为_____________
②若燃煤的含硫量(硫单质)为4%,燃烧1吨该燃煤生成的SO2有96%转化为生石膏,然后经过加热脱水形成熟石膏(2CaSO4·H2O),则可获得熟石膏_____________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com