
【题目】恒温恒容密闭容器中,发生反应如下:X(g) + 2Y(g) ![]() W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
A. Y的物质的量浓度B. 混合气体的密度
C. 混合气体的压强D. X的转化率
【答案】B
【解析】
从化学平衡的本质(正逆反应速率)和特征(各物质的物质的量或浓度)两方面分析判断。注意反应容器恒温恒容。
A项:Y的物质的量浓度不变时,其它各物质 的浓度必然不变,一定是化学平衡,A项不符合题意;
B项:该反应中所有物质都是气体,混合气体总质量必然不变,恒容时气体密度也必然不变,即容器内气体密度不变,不一定是化学平衡,B项符合题意;
C项:据pV=nRT,恒温恒容的容器内混合气体的压强不变时,气体的总物质的量也不变。对于反应前后气体分子数有变化的反应,气体的总物质的量不变必为化学平衡,C项不符合题意;
D项:当X的转化率不变时,容器内各成分的物质的量必然不变,一定是化学平衡,D项不符合题意。
本题选B。


科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX和2molY发生反应:X(g)+2Y(g)![]() mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A. 两次平衡的平衡常数相同B. m=3
C. X与Y的平衡转化率之比为1:2D. 第二次平衡时,Z的浓度为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种物质:

⑴ 乙中含有的官能团的名称为_______。
⑵由甲转化为乙需经下列过程(已略去各步反应的部分产物,下同):
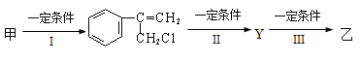
反应Ⅰ类型_______;反应II的条件是______;反应III的化学方程式为_______(不需注明反应条件)。
⑶由甲出发合成丙的路线之一如下:
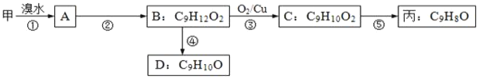
①下列物质不能与B反应的是______(选填序号)。
a.金属钠 b.FeCl3溶液 c.Na2CO3溶液 d.HBr溶液
②C的结构简式为 _______;第⑤步反应类型_________;
③任写一种能同时满足下列条件的D的同分异构体的结构简式_________。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
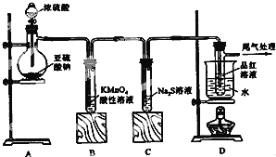
下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是___ ,发生反应的化学方程式为___;
(2)实验过程中,装置B、C中发生的现象分别是___、___,这些现象分别说明SO2具有的性质是___和___;装置C中发生反应的离子方程式为___;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___;
(4)尾气可采用___溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
![]()
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的___。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是___;C的化学式是___。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
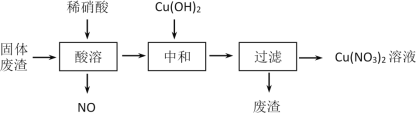
(1)Cu与稀硝酸反应的离子方程式为___。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___,若保持反应温度为70℃,欲加快反应速率可采取的措施为___(写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为___。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为___,由Cu(NO3)2溶液制备Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com