
【题目】非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
![]()
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的___。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是___;C的化学式是___。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
【答案】H2SO4 酸雨 N2 NO2 Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O 属于
【解析】
依据图示中的连续氧化转化关系和D为含氧酸且为强酸,可确定D为![]() 或
或![]() 。
。
(1) ①由A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体可知,A是S、B是SO2,则C是SO3、D是H2SO4,故答案为:H2SO4;
②SO2溶于水生成亚硫酸,溶液的pH小于5.6,则在工业生产中大量排放的SO2被雨水吸收后会形成酸雨,故答案为:酸雨;
(2)①A在常温下为气体,C是红棕色的气体可知,A为N2、C为NO2,则B为NO、D为HNO3,故答案为:N2;NO2;
②在常温下浓硝酸可与铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式为反应Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O,反应中有元素化合价的升降,该反应属于氧化还原反应,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;属于。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】5.6 g铁粉投入到足量的100 mL 2 mol·L1的稀硫酸中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol·L1·min1B.v(H2SO4)=1 mol·L1·min1
C.v(H2SO4)=0.5 mol·L1·min1D.v(FeSO4)=1 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中,发生反应如下:X(g) + 2Y(g) ![]() W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
W(g) + Z(g)。下列物理量不再改变,不能表明反应是否已达到平衡状态的是
A. Y的物质的量浓度B. 混合气体的密度
C. 混合气体的压强D. X的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A. 在稀CH3COOH溶液中加入少量CH3COONa固体,醋酸的浓度增大,电离程度减小
B. CH3COOH溶液与Na2CO3溶液反应生成CO2,可以证明CH3COOH是弱酸
C. 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-) = c(I-)
D. 室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[![]() ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________;CaCN2中阴离子为CN![]() ,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(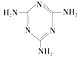 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
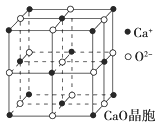
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________,Ca2+采取的堆积方式为____________________________,每个Ca2+周围距离最近且相等的Ca2+有________个。
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( ):
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪也叫冬眠灵,是第一个抗精神病药,开创了药物治疗精神疾病的历史,某研究小组利用下列途径合成盐酸氯丙嗪。

已知: 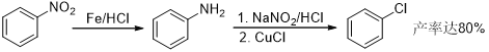
请回答:
(1) B中含有官能团名称为__________________;
(2) 下列说法不正确的是____________;
A. 化合物B可以发生加成反应
B. 化合物D在一定条件下既可与酸反应,又可以与碱反应
C. 合成路线中属于取代反应的为(1) (3) (4) (6)
D. 反应(7)是为了提高氯丙嗪的水溶性
(3) 写出E→F的化学反应方程式________________________________________________。
(4) 该研究小组在实验中发现,苯环上直接用Cl2取代的产率一般不到10%,请你设计合理步骤,利用甲苯为原料,合成化合物C________。(注:苯甲酸的苯环上发生取代反应时,取代主要发生在羧基的间位)
(5) 请写出符合下列条件的所有E的同分异构体________。
a. 分子中含有一个萘环![]() ,且为萘的邻位二取代物(邻位不包括
,且为萘的邻位二取代物(邻位不包括 );
);
b. 分子中有一个五元环;
c. 1H-NMR显示分子中有8种氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氮氧化物(NOx)的储存还原的工作原理:NOx的储存过程与还原过程在不同时刻是交替进行的。下列有关说法不正确的是( )

A.“还原”过程中,BaO转化为Ba(NO3)2
B.在储存还原过程中,Pt作催化剂
C.在储存还原过程中,参加反应的NO和O2的物质的量之比为2:1
D.若还原性气体为H2,则参加反应的H2与生成的N2的物质的量之比是5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com