
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
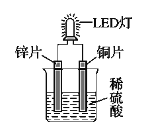
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 铜片上的电极方程式为:2H+ + 2e- = H2↑
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置 氧化废液中的溴化氢
氧化废液中的溴化氢
B.用装置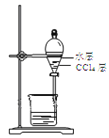 分离油层和水层
分离油层和水层
C.用装置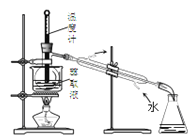 分离四氯化碳和液溴
分离四氯化碳和液溴
D.用仪器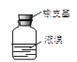 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的A、B、C、D、E、X均为中学化学常见物质。已知A为淡黄色固体,D为白色难溶于水的物质,且A和D的摩尔质量相等,在一定条件下它们有如下转化关系:
![]()
(1)写出A的电子式________。
(2)用离子方程式表示X的水溶液呈酸性的原因________ 。
(3)写出上述转化中C→D对应反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在25 ℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________________________________。
(2)Zn(s) + 1/2 O2(g) = ZnO(s) ΔH1 = -351 kJ/mol Hg(l) + 1/2 O2(g) = HgO(s) ΔH2 = -91 kJ/mol,由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= __________kJ/mol。
Ⅱ、二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡。改变下列条件之一,既能提高反应速率,又能提高CO的转化率的是________(填字母代号)。
a 降低温度 b 加入催化剂 c 缩小容器体积 d 增加H2的浓度
(2)该反应的化学平衡常数表达式K = _______________________,升高温度,平衡常数___________(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3 H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
① 反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”)
② 平衡时,n(CH3OCH3) = ________,平衡时CO2的转化率为________。
③ 平衡时,再向原容器中投入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,一段时间后达到新的平衡,此时CO2的转化率与原平衡相比________(填“增大”、 “减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。

(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。

(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com