
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
【答案】C
【解析】
A.放电时,电池的总反应为2Al+3I2=2AlCl3,Al的化合价升高,失去电子,作负极,电极反应方程式为Al-3e-=Al3+。导线中通过3.612×1024个电子,电子的物质的量![]() ,转移6mol电子,消耗2molAl,其质量为2mol×27g·mol-1=54g,A项错误;
,转移6mol电子,消耗2molAl,其质量为2mol×27g·mol-1=54g,A项错误;
B.电子不能经过电解质溶液,所以电子的流动方向不可能为Al电极→电解质溶液→石墨电极。充电时,电子的流动方向应为电源负极→Al电极,石墨电极→电源正极,B项错误;
C.假设金属质量均为1g,Li作负极时,1molLi失去1mol电子,转移的电子的物质的量![]() ;Al作负极时,1molAl失去3mol电子,转移的电子的物质的量
;Al作负极时,1molAl失去3mol电子,转移的电子的物质的量![]() ,相同质量情况下,Li失去的电子更多,C项正确;
,相同质量情况下,Li失去的电子更多,C项正确;
D.乙醇为非电解质,其溶液不导电,不能做电解质溶液。乙酸也不能做电解质溶液,由于铝会直接与乙酸反应生成H2。D项错误;
本题答案选C。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。
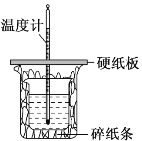
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
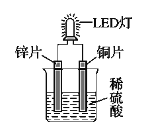
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 铜片上的电极方程式为:2H+ + 2e- = H2↑
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以由下列反应合成三聚氰胺:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[![]() ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________;CaCN2中阴离子为CN![]() ,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
,与CN22-互为等电子体的分子有CO2和________(填化学式),由此可以推知CN22-的空间构型为_______。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(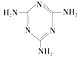 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (![]() )后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过__________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________,Ca2+采取的堆积方式为____________________________,每个Ca2+周围距离最近且相等的Ca2+有________个。
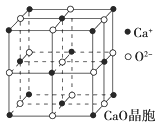
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( ):
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、X为周期表前四周期的元素,A→F原子序数依次增大。A位于第一周期,B原子有3个不同的能级,各能级的电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的电子层结构;F元素有“生物金属”之称,F4+离子和氩原子核外电子排布相同;X是第三周期电负性最大的元素。回答下列问题:
(1)F基态原子的核外电子排布式______________ ,用过量的E粉与 FX4高温条件下反应生成金属F,该化学方程式为___________________。
(2)在A与上述元素形成的分子中,中心原子采取sp3杂化的是________________(写出两种)。
(3)下图是BD2分子的晶胞模型,图中显示出的BD2分子数为14个。实际上一个BD2晶胞中含有__________个BD2分子。
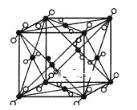
![]() 代表一个BD2分子
代表一个BD2分子
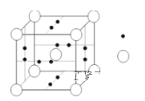
(4)B元素可形成B60单质,从晶体类型来看B60属于__________晶体。科学家把B60与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图(白球(C60)位于立方体的体心和顶点,小黑球(K)则位于立方体的面上),该化合物中B60与钾原子个数比为________________。
(5)已知单晶锗、晶体硅与金刚石的晶体类型完全相同,下图所示是金刚石的晶胞结构,请回答:
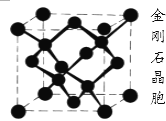
在单晶锗的一个晶胞内含有__________个锗原子。
(6)若向CuSO4溶液中加入少量氨水生成蓝色絮状沉淀,继续加入过量氨水沉淀溶解,得到深蓝色的透明溶液,最后向该溶液中加入一定量的乙醇,所析出晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)近年来,人类生产、生活所产生的污染物,使雾霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是_____________
A.灰霾属于纯净物 B.雾霾天气,儿童、老年人应减少户外活动
C.灰霾能发生丁达尔现象 D.减少燃煤用量能降低灰霾天气的产生频率
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统。雾丁达尔效应与水蒸汽有关,欲在树林中观察到丁达尔现象,你认为一天中最有可能观察到该现象的时间是____________,理由是___________________________________________________________
(3)为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2。该技术的工作原理是使烟气中的SO2与浆液中的石灰石以及鼓入的空气反应生成生石膏(CaSO4·2H2O)。
①写出该工艺的化学方程式:______________________________________;该反应中每消耗标况下11.2L SO2,转移电子的物质的量为_____________
②若燃煤的含硫量(硫单质)为4%,燃烧1吨该燃煤生成的SO2有96%转化为生石膏,然后经过加热脱水形成熟石膏(2CaSO4·H2O),则可获得熟石膏_____________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使酸性 KMnO4 溶液褪色②苯分子中碳原子间的距离均相等 ③苯能在一定条件下跟 H2 加成生成环己烷④经实验测得间二甲苯仅一种结构 ⑤苯在 FeBr3 存在条件下与液溴发生取代反应,但不因化学变化而使溴水褪色
A.②③⑤B.①②④⑤C.①②⑤D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com