
【题目】请回答下列问题:
(1)近年来,人类生产、生活所产生的污染物,使雾霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是_____________
A.灰霾属于纯净物 B.雾霾天气,儿童、老年人应减少户外活动
C.灰霾能发生丁达尔现象 D.减少燃煤用量能降低灰霾天气的产生频率
(2)雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统。雾丁达尔效应与水蒸汽有关,欲在树林中观察到丁达尔现象,你认为一天中最有可能观察到该现象的时间是____________,理由是___________________________________________________________
(3)为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2。该技术的工作原理是使烟气中的SO2与浆液中的石灰石以及鼓入的空气反应生成生石膏(CaSO4·2H2O)。
①写出该工艺的化学方程式:______________________________________;该反应中每消耗标况下11.2L SO2,转移电子的物质的量为_____________
②若燃煤的含硫量(硫单质)为4%,燃烧1吨该燃煤生成的SO2有96%转化为生石膏,然后经过加热脱水形成熟石膏(2CaSO4·H2O),则可获得熟石膏_____________吨。
【答案】BD 清晨 小水滴或冰晶被太阳加热,形成水雾,可能构成1nm—100nm的分散质,阳光透过树叶间隙形成光束,穿过这些水雾时会产生丁达尔效应 2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2CO2 1mol 0.174
【解析】
(1)胶体的分散质粒子直径在1-100nm,已知灰霾平均直径大约在1000~2000nm左右,则灰霾不属于胶体,不具有胶体的性质;
(2)清晨小水滴或冰晶被太阳加热,形成水雾,可能构成1nm—100nm的分散质,阳光透过树叶间隙形成光束,穿过这些水雾时会产生丁达尔效应;
(3)①由题意可确定该原理的反应物、生成物,该反应为氧化还原反应,根据得失电子守恒、元素守恒配平方程式;计算出SO2物质的量,结合S元素化合价的变化,确定转移电子的物质的量;
②根据硫元素守恒进行计算。
(1)胶体的分散质粒子直径在1-100nm,灰霾粒子比较小,平均直径大约在1000~2000nm左右,则灰霾不属于胶体,不具有胶体的性质,
A. 灰霾是空气和固体颗粒形成的混合物,A项错误;
B. 雾霾是雾和霾的混合物,霾的核心物质是悬浮在空气中的烟、灰尘等物质,空气相对湿度低于80%,颜色发黄。气体能直接进入并粘附在人体下呼吸道和肺叶中,对人体健康有伤害,故雾霾天气,儿童、老年人应减少户外活动,B项正确;
C. 灰霾粒子比较小,平均直径大约在1000~2000nm左右,其粒子直径比可见光(400nm-700nm)大,不能发生光的散射,没有丁达尔现象,C项错误;
D. 减少燃煤用量能够减少有害气体以及烟尘的排放,能降低灰霾天气的产生频率,D项正确;
故答案为:BD;
(2)清晨小水滴或冰晶被太阳加热,形成水雾,可能构成1nm—100nm的分散质,阳光透过树叶间隙形成光束,穿过这些水雾时会产生丁达尔效应;
故答案为:清晨;清晨小水滴或冰晶被太阳加热,形成水雾,可能构成1nm—100nm的分散质,阳光透过树叶间隙形成光束,穿过这些水雾时会产生丁达尔效应;
(3)①为了消除SO2的污染,工业上采用石灰石-石膏湿法烟气脱硫工艺来降低含硫燃料燃烧排放的SO2,由题意知,该原理的反应物为CaCO3、SO2、O2、H2O,生成物为CaSO4·2H2O、CO2,该反应为氧化还原反应,根据得失电子守恒、元素守恒配平方程式为:2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2CO2;该反应每消耗标况下11.2L SO2,即0.5mol SO2,S元素化合价由+4价升高为+6价,则转移电子的物质的量为0.5mol×2=1mol;
故答案为:2CaCO3+2SO2+O2+4H2O=2CaSO42H2O+2CO2;1mol;
②S的物质的量为![]() ,由硫元素守恒可得,
,由硫元素守恒可得,![]() ,生石膏(CaSO4·2H2O)物质的量为:
,生石膏(CaSO4·2H2O)物质的量为:
![]() ,则熟石膏(2CaSO4·H2O)物质的量为
,则熟石膏(2CaSO4·H2O)物质的量为![]() ,则熟石膏(2CaSO4·H2O)的质量为
,则熟石膏(2CaSO4·H2O)的质量为![]() ;
;
故答案为:0.174。


科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
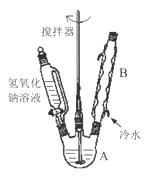
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
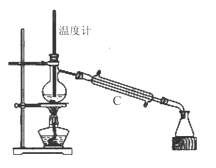
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氢氧化铁胶体以及在胶体中滴加适量HI溶液,其过程如下图所示,下列说法错误的是
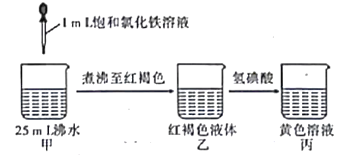
A.氢氧化铁胶体带正电荷,能聚沉水中带负电荷的杂质
B.乙转化为丙过程中发生聚沉、复分解反应、氧化还原反应
C.利用丁达尔效应可验证乙中是否生成了胶体
D.煮沸的目的是促进Fe3+水解生成更多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
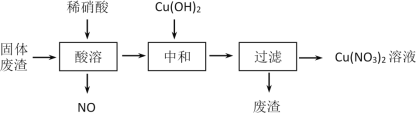
(1)Cu与稀硝酸反应的离子方程式为___。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___,若保持反应温度为70℃,欲加快反应速率可采取的措施为___(写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为___。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为___,由Cu(NO3)2溶液制备Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。

(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。

(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物基不饱和聚酯(UPOEM)具有出色的热稳定性、机械性和耐腐蚀性,广泛应用在包装、医用缝合线和药物封装等领域。其制备的核心反应如下:

下列说法正确的是
A.该反应为加聚反应
B.聚酯中不存在顺反异构
C.1mol III最多可与3mol H2反应
D.根据上述反应机理,可推知:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com