
����Ŀ���������⡿����ȩ������ˮ���������л��ܼ����ܶ�Լ����ˮ���ܶȣ��ڼ��������·����绯��Ӧ�����Ʊ�����ȩ����ˮ���ܽ�Ȳ����������л��ܼ����ܶ�Լ����ˮ���ܶȣ��������ᡣ��Ӧԭ�����£�
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
������������������±���
����ȩ | ���״� | ������ | �� | |
�е�/�� | 178 | 205 | 249 | 80 |
�۵�/�� | 26 | -15 | 122 | 5.5 |
��������ˮ�е��ܽ�� | ||
17�� | 25�� | 100�� |
0.21g | 0.34g | 5.9g |
ʵ���������£�

��1���ڢ�����������1Сʱ����ͼ1�������м��Ȼ�Ϲ̶�װ��Ϊ������
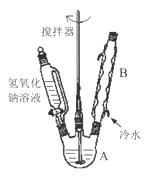
����A������Ϊ_______����������B��Ϊ����C��Ч������B��˵��ԭ��_______��
��2���������йط�Һ©����ʹ�ò���ȷ����_______
A.��Һ©����ʹ��֮ǰ��������Ƿ�©ˮ
B.��Һ©���ڵ�Һ�岻�ܹ��࣬����������
C.�����Һ©����������̨�Ͼ��ã��ֲ���������������з�Һ
D.��Һʱ���²�Һ�����������ر������������ձ��ٴ�����ʹ�ϲ�Һ������
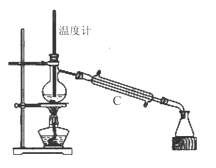
��3�����������÷�ˮԡ���������ٽ��в����ܣ���ͼ2�����ռ�______�����֡�ͼ2����һ�����Դ�����ȷ��Ӧ��Ϊ_____________��
��4������ʱ����ͼ3���ձ��б����ᾧ��ת�벼��©��ʱ�������ϻ�ճ���������壬��_____��ϴ�����ϲ����ľ��塣������ɺ���������ˮ�Ծ������ϴ�ӣ�ϴ��Ӧ____________��
��5���õ�����ƽȷ��ȡ0.2440g����������ƿ�м�100mL����ˮ�ܽ⣨��Ҫʱ���Լ��ȣ�������0.1000mol/L�ı�����������Һ�ζ��������ı�����������Һ19.20mL��������Ĵ���Ϊ_____%��
���𰸡� ������ƿ����������ƿ�� B�ĽӴ��������ȴ��������ȩ��Ч���� CD 205 �¶ȼƵ�ˮ������������ƿ��֧�ܿ� ��Һ ��Сˮ��ͷ 96.00
�����������⿼���л���ĺϳɼ������ķ��룬��ȷ��Ӧԭ�������ʵ����ʡ������ķ���ԭ�������ʼ��㷽���ǽ����Ĺؼ���
��1������װ��ͼ��֪����aΪ������ƿ������BΪ���������ܣ�����CΪֱ�������ܣ�B�ĽӴ��������ȴ��������ȩ��Ч���ã�������������B��Ϊ����C��Ч������B��
��2��A.��Һ©�����в�����������ʹ��֮ǰ��������Ƿ�©ˮ����A��ȷ��B.��Һ©���ڵ�Һ�岻�ܹ��࣬������������B��ȷ��C.����������֮ǰ��Ӧ��ʹ��Һ©�����������ϵİ��ۻ�С��©���Ͽھ�����С�ף�ʹ�������ͨ����C����D.��Һʱ���²�Һ�����������ر������������ձ����ӷ�Һ©���Ͽڽ��ϲ�Һ�嵹������D����ѡCD��
��3����������Ŀ���ǵõ����״���֣������ռ�205�����֣�����ʱ���¶ȼƲ������DZ��״��������¶ȣ������¶ȼƵ�ˮ����Ӧ����������ƿ��֧�ܿ�����
��4�����ձ��е������ᾧ��ת�벼��©��ʱ��������������ճ���������壬��ѡ��Һ�彫�����ϵľ����ϴ������ת�벼��©����Ŀ���Ǽ��پ������ʧ������ѡ���ϴ��Һ��Ӧ���Dz���ʹ�����ܽ���ʧ��Ҳ����������ʵģ�ѡ������Һ����ϴ����õġ�������ɺ���������ˮ�Ծ������ϴ�ӣ�ϴ��Ӧ��Сˮ��ͷ��
��5�����ݻ�ѧ��ӦC6H5COOH+NaOH= C6H5COONa+H2O����Ӧ����0.1000mol/LNaOH��Һ19.20mL�����ʵ���Ϊ0.1000mol/L��0.0192L=0.00192mol��������Ĵ���Ϊ��0.00192mol��122g/mol����0.2440g��100%=96.00%��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ����ʯ��ˮ�м����2H++Ca(OH)2=Ca2++2H2O
B. ��NaHCO3��Һ�м���NaOH��Һ��HCO3-+OH-=CO32-+H2O
C. ��������ˮ��Cl2+H2O![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
D. ��Ba(OH)2��Һ�еμ�ϡ���Ba2++OH-+H++SO42-=BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��a��b��c�����ڱ��е�λ����ͼ�������й�������Ԫ�ص�������ȷ���ǣ� ��
a | ||
b | ||
c |
A.a��һ�ֻ��õķǽ���Ԫ��
B.c������������ˮ������һ������
C.b���⻯����ȶ�
D.bԪ�ص��������Ϊ+7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų���������������NOx����CO2��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
������������֪��H2��ȼ����Ϊ285.8kJ��mol-1
N2��g��+2O2��g����2NO2��g�� ��H��+133kJ��mol-1
H2O��g����H2O��l) ��H��-44kJ��mol-1
���������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ______________
������̼����2L�ܱ������м���2mol CO2��6mol H2�����ʵ��Ĵ��������£�������Ӧ��
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
��1���ٸ÷�Ӧ�Է����е������� ������¡��������¡��������¶ȡ���
������������˵���˷�Ӧ�ﵽƽ��״̬���� ��
a����������ƽ��ʽ�����ֲ���
b��CO2��H2������������ֲ���
c��CO2��H2��ת�������
d�����������ܶȱ��ֲ���
e��1molCO2���ɵ�ͬʱ��3molH-H������
��2������״���������ȼ�ϵ�أ��õ���Dz��ò���̼������Ϊ�缫��������ϡ������Һ��ֱ�Ӽ��봿����ļ״���ͬʱ��һ���缫ͨ����������������ĵ缫��Ӧʽ��___________________
2����Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1���п�ѧ�����������FeO���պ�����CO2������Ȼ�ѧ����ʽ���£�6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ��H=-76.0 kJ��molһ1������Ӧ��ÿ����1 mol Fe3O4��ת�Ƶ��ӵ����ʵ���Ϊ_________mol��
��2����һ����������������̼ת��Ϊ����ķ�Ӧ������
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1��H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����CO2��ƽ��ת����Ϊ____________��300 ��ʱ������Ӧ��ƽ�ⳣ��K=____________________��200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_________(���������<��)O��
CH4(g)+2H2O(g)����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2 mol��Lһ1��H2 0.8 mol��Lһ1��CH40.8 mol��Lһ1��H2O1.6 mol��Lһ1����CO2��ƽ��ת����Ϊ____________��300 ��ʱ������Ӧ��ƽ�ⳣ��K=____________________��200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H_________(���������<��)O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж���Ħ����������ȷ������ ��
A��Ħ���ǹ��ʿ�ѧ�罨����õ�һ��������
B��Ħ�������ʵ����ĵ�λ�����Ħ������mol
C��Ħ���������ʵĺ�������������ӵ�������ϵ����
D�������Ϲ涨��0.012Kg̼ԭ��������̼ԭ����Ϊ1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��CuSO4��ˮ��Һ�� ����ᡱ�����С�������� �ԣ�ʵ����������CuSO4����Һʱ������CuSO4���������������У�Ȼ����������ˮϡ�͵������Ũ�ȣ��� ����ٽ����������ơ�����ˮ�⡣
��2����ĭ������е���Ҫ�ɷ���Al2(SO4)3��NaHCO3��Һ����Ӧ�����ӷ���ʽΪ
��3�������ӷ���ʽ��ʾ������ˮԭ��_________________
��4������Ag2S(s)![]() 2Ag+(aq)+ S2-(aq)����Ksp=____________��
2Ag+(aq)+ S2-(aq)����Ksp=____________��
��5������˵������ȷ����__________��
A����ϡ����ϴ��AgCl��������ˮϴ�����AgClС��
B�����ʵ��ܽ�����¶ȵ����߶����ӣ������ʵ��ܽⶼ�����ȵģ�
C������Al(OH)3(s)![]() Al(OH)3(aq)
Al(OH)3(aq)![]() Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻
Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻
D����ȥ��Һ�е�Mg2+����OH-����Mg2+����CO32-Ч���ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3��
E��������Ӧ�г��ӹ����ij���������Ŀ����ʹ������ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ԫ�����ڱ���ǰ�����ڣ�
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
һ | A | |||||||
�� | B | C | D | E | F | |||
�� | G | H | I | |||||
�� | J |
�ش��������⣺
��1��GԪ����EԪ���γɺ��зǼ��Լ��Ļ�����Ļ�ѧʽ��____��I��J��ԭ���������Ϊ_____��
��2������10��Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ����__���û�����Ļ�ѧʽ��ʾ����ͬ����������ǿ����_____��E��F��G����Ԫ���γɵļ����Ӱ뾶�ɴ�С��˳����_______�������ӷ��Żش𣩣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2014��߿����վ���20�⡿�����ת������Դ���úͻ�����������Ҫ�о����⡣�������������ж��ַ�����
��1�����ռ�����H2S�����Һ���뵽����20ͼ��1��ʾ�ĵ��ص����������е�⡣���������������������·�Ӧ��S2����2e��S ��n��1��S+ S2�� Sn2��
��д�����ʱ�����ĵ缫��Ӧʽ�� ��
����������������Һ��ϡ�����ữ�õ����ʣ������ӷ���ʽ��д�� ��
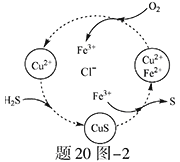
��2����H2S�Ϳ����Ļ������ͨ��FeCl3 ��FeCl2 ��CuCl2�Ļ����Һ�з�Ӧ����S��������ת������20ͼ��2��ʾ��
����ͼʾ��ת���У����ϼ۲����Ԫ���� ��
����Ӧ�е���1molH2Sת��Ϊ����ʱ��������Һ��Fe3�������ʵ������䣬��Ҫ����O2�����ʵ���Ϊ ��
�����¶�һ���Ͳ�������Һ�������£�����ͨ�������壬����ֽ��衣��ʹ���ɵ������в���CuS���ɲ�ȡ�Ĵ�ʩ�� ��
��3��H2S�ڸ����·ֽ�������������H2������Ӧ�ڲ�ͬ�¶��´ﵽƽ��ʱ����������и���ֵ������������20ͼ��3��ʾ��H2S�ڸ����·ֽⷴӦ�Ļ�ѧ����ʽΪ ��

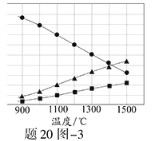
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���������CH3OCOOCH3�����DMC������һ��Ӧ��ǰ���㷺���²��ϣ�ʵ�����п��ü״���CO��CO2�Ƚ��кϳɡ��ش��������⣺
��1��������̼�ĵ���ʽΪ _________________
��2���ü״���CO��O2�ڳ�ѹ��70��120��ʹ����������ºϳ�DMC��
��֪����CO�ı�ȼ����Ϊ��283.0kJmol1��
��1mol H2O��l����ȫ�������H2O��g��������44kJ������
��2CH3OH��g����CO2��g��CH3OCOOCH3��g����H2O��g����H��15.5kJmol1
��2CH3OH��g����CO��g����1/2O2��g��CH3OCOOCH3 ��g����H2O��l����H��_____��
�÷�Ӧ�ڳ�ѹ��70��120�������¾����Է���Ӧ��ԭ����_______________��
��3����������Ӧ��֪�״���CO2��ֱ�Ӻϳ�DMC���״�ת����ͨ�����ᳬ��1%����Լ�÷�Ӧ����ҵ��������
��д���÷�Ӧƽ�ⳣ������ʽ��______________ ��
���ں����ܱ������з���������Ӧ����˵���Ѵﵽƽ��״̬����____��ѡ���ţ���
A��v����CH3OH����2v����CO2��
B��CH3OCOOCH3��H2O�����ʵ���֮�ȱ��ֲ���
C��������������ܶȲ���D��������ѹǿ����
��ij�о�С����ij�¶��£���100mL�����ܱ�������Ͷ��2.5mol CH3OH��g��������CO2��6��105 mol�������о���Ӧʱ��Լ״�ת������TON����Ӱ�죬��仯������ͼ1��ʾ�������㹫ʽΪ��TON��ת���ļ״������ʵ���/���������ʵ�������

�ڸ��¶��£���ѷ�Ӧʱ����_________h��4��10h��DMC��ƽ����Ӧ������_______ ��
��4���Զ�ײ�Ϊ�缫��������ͼװ����A��B�ڷֱ�ͨ��CH3OCOOCH3��O2����ȼ�ϵ�أ���д���õ�ظ����ĵ缫��Ӧʽ____________________________

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com