
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为 _________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:283.0kJmol1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)△H=15.5kJmol1
则2CH3OH(g)+CO(g)+1/2O2(g)CH3OCOOCH3 (g)+H2O(l)△H=_____。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________ ;
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是____(选填编号).
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×105 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。

在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ .
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________

【答案】![]() -342.5 kJmol1因为该反应△H<0 △S<0 ,在较低温度下可以自发进行
-342.5 kJmol1因为该反应△H<0 △S<0 ,在较低温度下可以自发进行![]() AD107.5×10-4 molL1h-1CH3OCOOCH3-12e-+18OH-= 3CO32-+ 12H2O
AD107.5×10-4 molL1h-1CH3OCOOCH3-12e-+18OH-= 3CO32-+ 12H2O
【解析】本题考查热化学、电化学、化学平衡有关知识点,知识跨度大,熟练掌握相关知识点,能较好的完成本题。
(1)二氧化碳为共价化合物,碳与氧原子间共用四个电子,电子式为![]() ,
,
(2)根据盖斯定律作答,根据CO的燃烧热有①CO(g)+1/2O2(g)=CO2(g) △H1=283.0kJmol1,②H2O(l)=H2O(g) △H2=+44kJmol1,③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)△H3=15.5kJmol1,所要求的方程式为上述三个方程式①+③-②即可得到,则△H=△H1-△H2+△H3=-342.5 kJmol1 。该反应的△H<0,△S<0,根据吉布斯自由能可知,低温时,△G<0 ,反应可自发进行。
(3)① 2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)根据平衡常数的概念有,![]()
② v正(CH3OH)=2v逆(CO2),速率方向相反,比例正确,能说明达到平衡,A正确。若开始只充入反应物,CH3OCOOCH3与H2O的物质的量之比始终保持不变,故不能说明是否平衡,B错误。容器容积一定,气体质量不变,密度始终不变,不能说明已打平衡,C错误。该反应是一个气体物质的量减小的反应,恒容下,压强不变,说明气体的物质的量不再变化,可以说明达到平衡,D正确。故选AD。
③ 由图可知,反应10小时时,TON较大,10小时后,TON变化不明显,故最佳反应时间为10小时。6小时内,甲醇的物质的量改变值为(35-20)*6*10-5mol=9*10-4mol,浓度改变值为9*10-4mol/0.1L=9*10-3mol/L,甲醇的速率为9*10-3/6=1.5*10-3( molL1h-1),DMC的速率为甲醇的1/2,所以4~10h内DMC的平均反应速率是7.5×10-4 molL1h-1。
(4)该电池为燃料电池,A极通入燃料CH3OCOOCH3,做负极,发生氧化反应,电解质为KOH,负极反应为CH3OCOOCH3-12e-+18OH-= 3CO32-+ 12H2O


科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
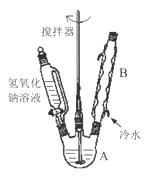
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
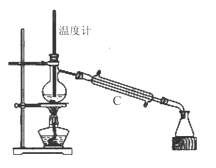
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A .分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C .分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物分子中,所有的碳原子可能不处于同一平面上的是
A. CH2=CH-CH3
B. C6H5-CH=CH2
C. C6H5-CH3
D. CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液混合,①、②分别与③混合,实验测得产生的CO2气体体积(V)随时间(t)的变化如图所示,下列说法正确的是( )
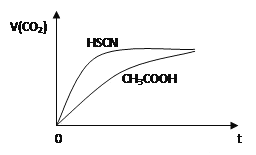
A. 三种溶液pH的比较③>②>①
B. 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C. 上述三种溶液中水电离的电离度:NaHCO3>CH3COOH>HSCN
D. ①与③反应所得的溶液中:c(CH3COO-) + c(CH3COOH) = 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:2SO2(g) + O2(g) ![]() 2SO3(g)△H=﹣196kJmoL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO3(g)△H=﹣196kJmoL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
A.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆)
B.相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20%
C.平衡混合气体中S02的物质的量为1.2mol
D.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光导纤维是由下列哪种物质经特殊工艺制成的
A.石墨 B.石英 C.石灰石 D.高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表数据,不能形成合金的是
Na | Cu | A1 | Fe | |
熔点/℃ | 97.8 | 1 083 | 660 | 1 535 |
沸点/℃ | 883 | 2 567 | 2 467 | 2 750 |
A. Cu和A1 B. Fe和Na C. Fe和Cu D. A1和Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com