
【题目】下列离子方程式正确的是
A. 澄清石灰水中加盐酸:2H++Ca(OH)2=Ca2++2H2O
B. 向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-=CO32-+H2O
C. 氯气溶于水:Cl2+H2O![]() 2H++ClO-+Cl-
2H++ClO-+Cl-
D. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)![]() 2AB3(g)的化学平衡状态的影响如右下图所示(T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g)的化学平衡状态的影响如右下图所示(T表示温度,n表示物质的量)。下列判断正确的是( )

A.反应速率:a>b>c
B.达到平衡时A的转化率大小:b>a>c
C.若T2>T1.则正反应一定是吸热反应
D.达到平衡时,n( AB3)的大小:b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,有关说法中正确的是
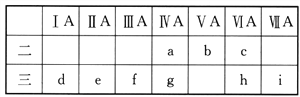
① a、b、e、f四种元素的原子半径:e>f>b>a
② h、i两种元素阴离子的还原性:h>i
③ a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强
A. ①③④ B. ②③⑤ C. ②④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨基酸和蛋白质的认识不正确的是
A. 氨基酸和蛋白质都是两性分子
B. 蛋白质可发生水解,最终得到各种氨基酸
C. 强紫外线灼伤人体皮肤属于皮肤蛋白质的颜色反应
D. 酶是生物体内许多复杂反应的高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《后汉书·郡国志》中记载:“石出泉水…其水有肥,燃之极明,不可食,县人谓之石漆。”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明。”这里的“石漆”“石脂水”是指
A. 油脂 B. 油漆 C. 石油 D. 煤焦油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______________。
A.每生成1 mol H—Cl键吸收431.4 kJ能量
B. 每生成1 mol H—Cl键放出431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D. 每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是___________。
化学键 | H—H | H—F | H—Cl | H—Br |
键能/kJ/mol | 436 | 565 | 431 | 368 |
A. H2 B. HF C. HCl D. HBr
(3)能用键能大小解释的是____________。
A 常温常压下,溴呈液态,碘呈固态 B.氮气的化学性质比氧气稳定
C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,常温下,4mol HCl被氧化,放出115.6kJ的热量.
写出该反应的热化学方程式_____________________.
(5)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1mol产物的数据)
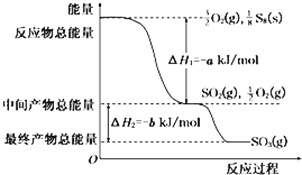
①写出表示S8燃烧热的热化学方程式:______________.
②写出SO3分解生成SO2和O2的热化学方程式:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)![]() Si(s)+2ZnCl2(g)ΔH1
Si(s)+2ZnCl2(g)ΔH1
SiCl4(g)+2Zn(g)![]() Si(s)+2ZnCl2(g)ΔH2
Si(s)+2ZnCl2(g)ΔH2
下列说法正确的是
A.Zn(l)=Zn(g)ΔH=1/2(ΔH1-ΔH2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,ΔH2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
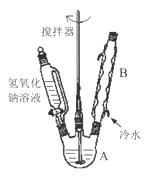
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
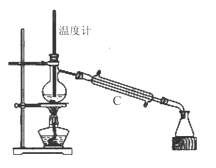
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com