
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
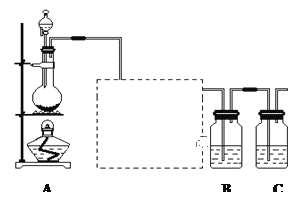
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
【答案】浓HCl MnO2 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
【解析】
(1)从实验室制取氯气的原理分析;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易;其最高价氧化物对应水化物的酸性越强;与变价金属反应生成高价态的非金属性较强。
(1)根据实验目的可知,验证氯元素的非金属性比硫元素的非金属性强,则装置A为制取氯气的装置,其反应原理为浓盐酸与二氧化锰共热,则分液漏斗中盛有浓盐酸,其反应的离子方程式为:MnO2+ 4H+ +2Cl-(浓)![]() Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl-
Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水,故答案为:饱和食盐水;除去Cl2中的HCl气体;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫,方程式为:Na2S+Cl2=2NaCl+S↓,离子方程式为:Cl2+S2-=S↓+2Cl-,现象为:有黄色沉淀生成,故答案为:A;有黄色沉淀生成;Cl2+S2-=S↓+2Cl-;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易,则④正确;其最高价氧化物对应水化物的酸性越强,则①错误、②正确;与变价金属反应生成高价态的非金属性较强,则⑥正确;对应离子的还原性越弱,则③正确;综上正确为:②③④⑥,答案为:B。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】(1)下列选项中互为同系物的是__________;互为同分异构体的是__________;属于同种物质的是__________。
①H2O与D2O;②1H、2H、3H;③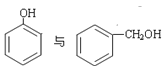 ;④
;④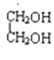 与
与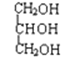 ;⑤
;⑤ ![]() ;⑥戊烯与环戊烷; ⑦
;⑥戊烯与环戊烷; ⑦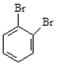 与
与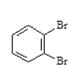
(2)羟基、羧基的性质具有明显的差异,为实现如图所示的各步转化,请在括号内填入适当试剂的化学式。
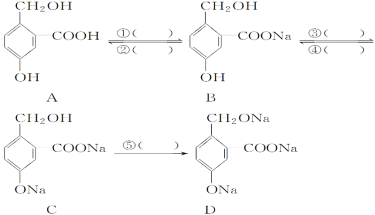
①__________;②__________;③__________;④__________;⑤__________;
(3)聚碳酸酯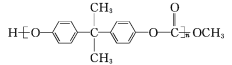 的透光率良好,可制作车、船、飞机的挡风玻璃等。①原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯(
的透光率良好,可制作车、船、飞机的挡风玻璃等。①原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯(![]() )与____(填序号)缩合聚合而成。
)与____(填序号)缩合聚合而成。
A.二卤代物 B.二酚类 C.二醛类 D.二烯类
②写出用绿色化学原料合成聚碳酸酯反应的化学方程式____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40 ℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
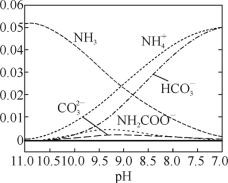
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 随着CO2的通入,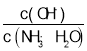 不断增大
不断增大
C. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA
C. 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究铜片与浓H2SO4反应及产物的化学性质,设计了如图实验装置。请回答下列问题:
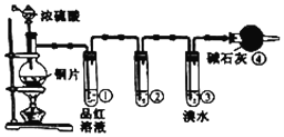
(1)图中仪器a的名称:______。装置④的作用是______。
(2)写出铜片与浓H2SO4共热发生反应的化学方程式:______。
(3)为了验证SO2是酸性氧化物,试管②中可选择的试剂是______![]() 填序号
填序号![]() 。
。
a、酸性KMnO4溶液 b、紫色石蕊试液 c、Na2S溶液
(4)下列说法正确的是______。
A.先检査装置的气密性,再向装置中加入药品
B.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
C.实验开始后,试管①和③溶液均褪色,两者均可证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.8.7gMnO2与40mL10mol·L-1的浓盐酸充分反应,生成的氯气分子数小于0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.1.7gH2O2中含有的电子数为0.9NA
D.常温常压下,44g丙烷含有共价键的数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com