
【题目】下列说法不正确的是( )
A.NH4+与H3O+中心原子的价层电子对数相同
B.BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同
C.金属Zn晶体中的原子堆积方式为六方堆积
D.HOCH2CH(OH)CH2OH和(CH3)2CClCH2CH3都是手性分子
【答案】D
【解析】
A.NH4+分子中心原子N原子杂化轨道数=σ键数+孤对电子对数=4+![]() (5-1-4×1)=4,H3O+中心原子O原子杂化轨道数=σ键个数+孤电子对个数=3+
(5-1-4×1)=4,H3O+中心原子O原子杂化轨道数=σ键个数+孤电子对个数=3+![]() (6-1-3×1)=4,故A正确;
(6-1-3×1)=4,故A正确;
B.BF3中硼原子价层电子对个数=σ键个数+孤电子对个数=3+![]() ×(3-3×1)=3,无孤对电子,硼原子轨道的杂化类型为sp2,苯分子中C上无孤对电子,形成3个σ键,碳原子轨道的杂化类型为sp2,杂化类型相同,故B正确;
×(3-3×1)=3,无孤对电子,硼原子轨道的杂化类型为sp2,苯分子中C上无孤对电子,形成3个σ键,碳原子轨道的杂化类型为sp2,杂化类型相同,故B正确;
C.金属Zn晶体的原子堆积方式为六方最密堆积,故C正确;
D.HOCH2CH(OH)CH2OH和(CH3)2CClCH2CH3都不是手性分子,故D错误;
故答案为D。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mLAl2(SO4)3溶液中,含Al3+1.62 g,在该溶液中加入0.1molL﹣1Ba(OH)2溶液100mL,反应后溶液中SO42-的物质的量浓度约为( )
A. 0.4molL﹣1B. 0.3molL﹣1C. 0.2molL﹣1D. 0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学习探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
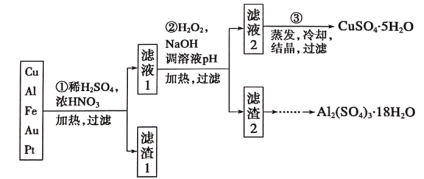
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_________;
得到滤渣I的主要成分为____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________;
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
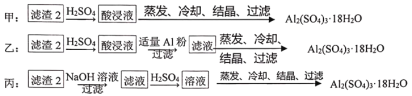
上述三种方案中,___方案不可行,原因是_____;从原子利用率角度考虑,___方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
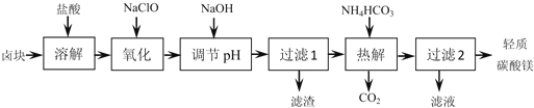
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂结构如图所示,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列说法正确的是( )
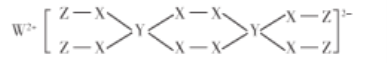
A.非金属性:X>W>Y
B.Y的最高价氧化为对应的水化物为三元酸
C.可利用W与X形成的化合物制备耐高温材料
D.该漂白剂中仅有X均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为![]() ,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
,原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
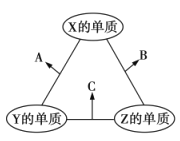
A.X元素位于ⅥA族
B.A不能溶解于B中
C.B的稳定性强于C
D.A和C不可能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com