
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.与![]() 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C.C5H12的一氯代物有8种
D.菲的结构简式为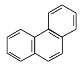 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______.
(2)含硫各微粒(H2SO3、![]() 和
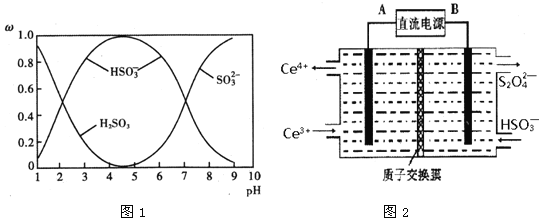
和![]() )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
①下列说法正确的是______(填标号).
A.pH=7时,溶液中c(Na+)=3c(![]() )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(![]() )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______.
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
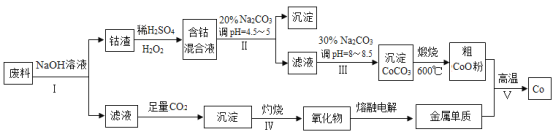
【题目】钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3 和Fe2O3等物质)。
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________(填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
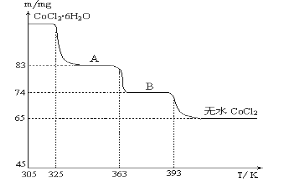
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高的药用价值的绿原酸(如图),下列说法错误的是

A.1 mol绿原酸与足量溴水反应,最多消耗4 mol Br2
B.绿原酸能发生取代、加成、消去和氧化反应
C.1 mol绿原酸与足量Na反应生成气体在标况下的体积为33.6L
D.绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol·L-1 NaOH溶液逐滴滴入10 mL 0.1 mol·L-1 NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:
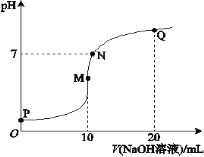
下列关系中,不正确的是
A.M点c(Na+)>c(![]() )
)
B.N点c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q点c(![]() )+c(NH3·H2O)=c(Na+)
)+c(NH3·H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B的基态原子核外电子排布式为____________________。
(2)BF3的立体构型是_____________________;HF能与BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(3)H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4]-,H3BO3 和[B(OH)4]-中B的杂化轨道类型分别为为____________ 、____________。
(4)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_____________,其中三种元素的电负性由大到小的顺序是__________________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如图所示,
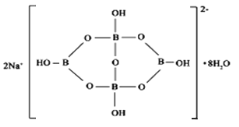
它的阴离子可形成链状结构,则该晶体中不存在的作用力是_________(填选项字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力
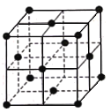
(6)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图所示,其堆积方式为____________,Li+占据阴离子组成的所有最小正四面体中心,该化合物的化学式为____________(用最简整数比表示)。假设晶胞边长为a pm,用NA代表阿伏加德罗常数的值,则该晶胞的密度为___________g/cm3(用含a,NA的代数式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
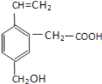
①所有碳原子可能共面;
②能使酸性KMnO4 溶液和溴水褪色,且原理相同;
③1mol 该有机物分别与足量 Na 或NaHCO3 反应,产生气体在标况下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol 该有机物完全燃烧生成 CO2 和H2O 消耗 O2 的体积为 280L(标准状况)
A.①②B.②⑥C.③⑥D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.NH4+与H3O+中心原子的价层电子对数相同
B.BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同
C.金属Zn晶体中的原子堆积方式为六方堆积
D.HOCH2CH(OH)CH2OH和(CH3)2CClCH2CH3都是手性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com