
【题目】室温下,将0.1 mol·L-1 NaOH溶液逐滴滴入10 mL 0.1 mol·L-1 NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:
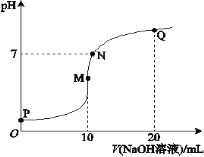
下列关系中,不正确的是
A.M点c(Na+)>c(![]() )
)
B.N点c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q点c(![]() )+c(NH3·H2O)=c(Na+)
)+c(NH3·H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
【答案】C
【解析】
A.M点溶液显酸性NH4HSO4+NaOH= NaNH4 SO4+H2O ,100mL0.lmol·L-1 NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液100mL,恰好完全反应,NH4+发生水解,所以显酸性,故A选项正确。
B.N点满足c(NH4+)+c(H+)+c(Na+) =c(OH-)+2 c(SO42-),N点PH=7,故c(H+)= c(OH-),所以上述式子可以写成c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -),故B选项正确。
-),故B选项正确。
C.Q点溶液中含有硫酸钠,氢氧化钠和氨水故根据物料守恒2c(![]() )+2c(NH3·H2O)=c(Na+)
)+2c(NH3·H2O)=c(Na+)
故C选项错误。
D.因为加酸和碱抑制水的电离,水解促进电离,所以 M、N、Q 三个点中,M点水的电离程度最大,N点PH为7,水解程度居中,Q点有氢氧化钠抑制水的电离,故水的电离程度最小,故D选项正确。
故答案选C。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:

(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是____。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是_____。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是____。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(l) ΔH1<0
Si(s) + 2ZnCl2(l) ΔH1<0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(g) ΔH2<0
Si(s) + 2ZnCl2(g) ΔH2<0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)![]() Si(s) + 2ZnCl2(g) ΔH3<0
Si(s) + 2ZnCl2(g) ΔH3<0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是____。
③ 已知Zn(l)=Zn(g) ΔH = +116 KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列有关问题.
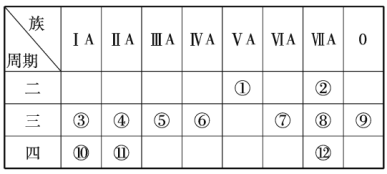
(1)写出下列元素符号:①______,⑥______,⑦______,______.
(2)这些元素中最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的氢氧化物是______,写出三者之间两两反应的化学方程式:______;______;______.
(4)这些元素(除0族元素外)中原子半径最小的是______(填元素符号,下同),原子半径最大的是______.
(5)在③与④中,单质的化学性质较活泼的是______(填元素符号),怎样用化学实验证明?______在⑧与中,单质的化学性质较活泼的是____________(填元素符号),怎样用化学实验证明?_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)写出乙烯分子的电子式:________。
(2)写出(2﹣甲基﹣1,3﹣丁二烯)的结构简式_____________。
(3)立方烷 ![]() 的一氯代物有__________种,它的六氯代物有________种。
的一氯代物有__________种,它的六氯代物有________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是________;互为同分异构体的是________;属于同种物质的是________。
①O2和O3 ②1H、2H、3H ③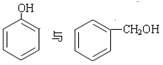 ④
④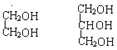 ⑤
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦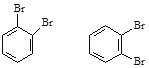
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有几种元素的微粒的电子层结构为 ,试回答下列问题:
,试回答下列问题:
(1)若该微粒代表一种原子,则这种微粒的符号是______;
(2)向该微粒(带负电荷)的盐溶液中加入![]() 溶液时会出现白色沉淀,则这种微粒的符号是______;
溶液时会出现白色沉淀,则这种微粒的符号是______;
(3)某原子失去一个电子形成该微粒,则这种微粒的符号是______;
(4)某原子得到两个电子形成该微粒,则这种微粒的符号是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
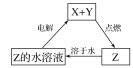
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
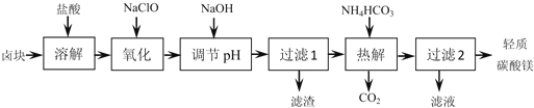
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com