
【题目】根据下表回答下列有关问题.
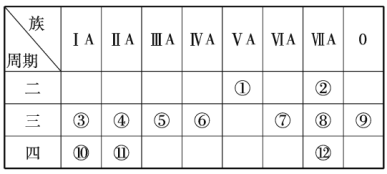
(1)写出下列元素符号:①______,⑥______,⑦______,______.
(2)这些元素中最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的氢氧化物是______,写出三者之间两两反应的化学方程式:______;______;______.
(4)这些元素(除0族元素外)中原子半径最小的是______(填元素符号,下同),原子半径最大的是______.
(5)在③与④中,单质的化学性质较活泼的是______(填元素符号),怎样用化学实验证明?______在⑧与中,单质的化学性质较活泼的是____________(填元素符号),怎样用化学实验证明?_____________________.
【答案】N Si S Ca K F Ar ![]()
![]()
![]()
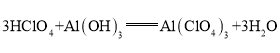
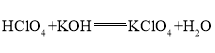
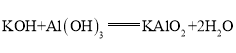 F K Na 将Na、Mg分别与冷水反应,
F K Na 将Na、Mg分别与冷水反应,![]() 跟冷水剧烈反应,放出氢气,Mg跟冷水不反应 Cl
跟冷水剧烈反应,放出氢气,Mg跟冷水不反应 Cl ![]() 将氯气通入溴化钠溶液中,溶液变为橙红色,发生的反应为
将氯气通入溴化钠溶液中,溶液变为橙红色,发生的反应为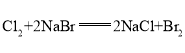
【解析】
根据元素在元素周期表中的位置,可知①~的具体元素,再结合元素周期律可知,最活泼的金属元素是![]() ,最活泼的非金属元素是
,最活泼的非金属元素是![]() ,最不活泼的元素是稀有气体元素
,最不活泼的元素是稀有气体元素![]() ,它们的最高价氧化物对应的水化物中酸性最强的是
,它们的最高价氧化物对应的水化物中酸性最强的是![]() ,碱性最强的是
,碱性最强的是![]() ,呈两性的氢氧化物是
,呈两性的氢氧化物是![]() .在比较Na与
.在比较Na与![]() 、
、![]() 与
与![]() 的活泼性差异时,可根据元素金属性、非金属性强弱比较的依据设计实验。
的活泼性差异时,可根据元素金属性、非金属性强弱比较的依据设计实验。
(1)据上分析可知,四种元素的符号分别为:①N,⑥Si,⑦S,Ca;
(2)据上分析可知:最活泼的金属元素是![]() ,最活泼的非金属元素是
,最活泼的非金属元素是![]() ,最不活泼的元素是稀有气体元素
,最不活泼的元素是稀有气体元素![]() ;
;
答案为:K; F;Ar;
(3)它们的最高价氧化物对应的水化物中酸性最强的是![]() ,碱性最强的是
,碱性最强的是![]() ,呈两性的氢氧化物是
,呈两性的氢氧化物是![]() ;氢氧化铝够与高氯酸、氢氧化钾反应,均生成盐和水,高氯酸与氢氧化钾反应生成盐和水,方程式分别为:
;氢氧化铝够与高氯酸、氢氧化钾反应,均生成盐和水,高氯酸与氢氧化钾反应生成盐和水,方程式分别为: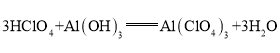 ,
,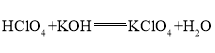 ,
,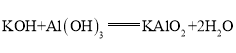 ;
;
答案为:![]() ;
; ![]() ;
;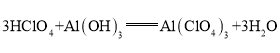 ;
;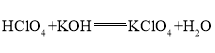 ;
;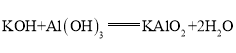 ;
;
(4)同周期从左到右原子半径递减,同主族从上到下原子半径递增,这些元素(除0族元素外)中原子半径最小的是F,原子半径最大的是K;
答案为:F;K;
(5)同周期从左到右金属性递减,化学性质Na>Mg,可通过与水反应放出氢气的剧烈程度来比较,钠与冷水剧烈反应,而镁与冷水不反应;
答案为:Na,将Na、Mg分别与水反应,![]() 跟水剧烈反应,放出氢气,镁与冷水不反应;
跟水剧烈反应,放出氢气,镁与冷水不反应;
同主族从上到下非金属性递减,单质的化学性质![]() >
>![]() ,可通过氯气能置换出溴来证明,氯气与溴化钠溶液反应,置换出溴,溶液显橙色,方程式为:
,可通过氯气能置换出溴来证明,氯气与溴化钠溶液反应,置换出溴,溶液显橙色,方程式为: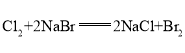 ;
;
答案为:Cl;将氯气通入溴化钠溶液中,溶液变为橙色,发生的反应为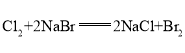 。
。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高温下能自发进行,则该反应ΔH>0、ΔS>0
B.常温下等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值增大
的值增大
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和 1,3-丁二烯为原料,经过下列反应合成高分子化合物 H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。

请按要求填空:
(1)写出下列反应的反应类型:反应①____________ ,反应⑤ _______________,反应⑧_____________________
(2)反应②的化学方程式是 ____________________
(3) 反应③、④中有一反应是与 HCl 加成,该反应是__________(填反应编号),设计这一步反应的目的是_______________________,物质 C 的结构简式是____________________ 。
(4)反应⑨的化学方程式是 _______________
(5)写出与 G 具有相同种类和数目的官能团的同分异构体:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域.一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
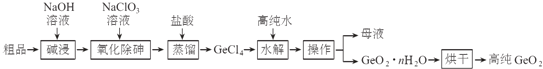
已知:①“碱浸”过程中的反应为:
GeO2+2NaOH=Na2GeO3+H2O
As2O3+2NaOH=2NaAsO2+H2O
②“蒸馏”过程中的反应为:Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
③GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃.
(1)锗的原子序数为32,锗在元素周期表中的位置为第 ______ 周期 ______ 族.
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应方程式为: ______ .
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 ______ .
(4)工业上与蒸馏操作相关的设备有 ______
A.蒸馏釜 B.离心萃取机 C.冷凝塔 D.加压过滤机
(5)“水解”操作时发生的化学反应方程式为 ______ ,“水解”操作时保持较低温度有利于提高产率,其最可能的原因是 ______ (答一条即可).
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的高纯二氧化锗产品,则杂质脱除率为 ______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上广泛应用于磁性材料、电池材料及超硬材料等领域。某学习小组欲从某工业废料中回收钴,设计工艺流程如下:(废料中含有Al、Co2O3 和Fe2O3等物质)。
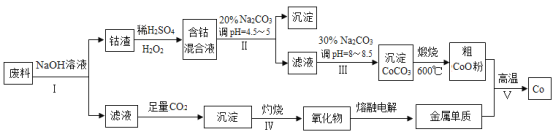
请回答:
(1)废料用NaOH溶液处理前通常先将废料粉碎,其目的是____________。
(2)过程Ⅱ用稀H2SO4和H2O2溶液与Co2O3反应而达到浸出钴的目的,请写出该反应的离子方程式___________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________。
(3)碳酸钠溶液在过程Ⅱ和Ⅲ中所起作用有所不同,请写出碳酸钠在过程Ⅱ中发生反应生成沉淀的离子方程式__________________________________。
(4) 若在实验室中完成过程Ⅳ,则沉淀物需在__________________(填仪器名称)中灼烧;写出在过程Ⅴ中发生反应的化学方程式__________________________________。
(5)将1.0×10-3 mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
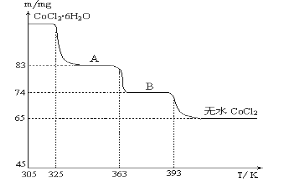
(6)CoO与盐酸反应可得粉红色的CoCl2溶液。CoCl2晶体因结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体在烘箱中受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.(A-N+2)molD.![]() (A-N+8)mol
(A-N+8)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1 mol·L-1 NaOH溶液逐滴滴入10 mL 0.1 mol·L-1 NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:
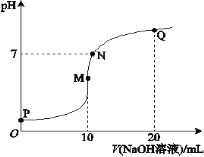
下列关系中,不正确的是
A.M点c(Na+)>c(![]() )
)
B.N点c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q点c(![]() )+c(NH3·H2O)=c(Na+)
)+c(NH3·H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是( )

A. 可以选用方案1分离碳酸氢钠中含有的氯化铵
B. 方案1中的残留物应该具有的性质是受热易挥发
C. 方案2中加入的试剂一定能够与除X外的物质发生化学反应
D. 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
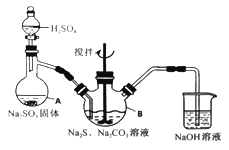
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为

为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com