
【题目】以石油裂解得到的乙烯和 1,3-丁二烯为原料,经过下列反应合成高分子化合物 H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。

请按要求填空:
(1)写出下列反应的反应类型:反应①____________ ,反应⑤ _______________,反应⑧_____________________
(2)反应②的化学方程式是 ____________________
(3) 反应③、④中有一反应是与 HCl 加成,该反应是__________(填反应编号),设计这一步反应的目的是_______________________,物质 C 的结构简式是____________________ 。
(4)反应⑨的化学方程式是 _______________
(5)写出与 G 具有相同种类和数目的官能团的同分异构体:_____。
【答案】加成反应 消去反应 取代反应  +2NaOH
+2NaOH![]()
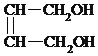 +2NaBr ③ 保护A分子中C=C不被氧化 HOOCCH2CHClCOOH nHOCH2CH2OH+nHOOCCH=CHCOOH
+2NaBr ③ 保护A分子中C=C不被氧化 HOOCCH2CHClCOOH nHOCH2CH2OH+nHOOCCH=CHCOOH![]()
 +(2n1)H2O CH2=C(COOH)2
+(2n1)H2O CH2=C(COOH)2
【解析】
1,3-丁二烯与溴发生1,4-加成反应生成1,4-二溴-2-丁烯,再发生卤代烃的水解反应生成A为HOCH2CH=CHCH2OH。乙烯与溴发生加成反应生成E为BrCH2CH2Br,E发生卤代烃的水解反应生成F为HOCH2CH2OH,结合反应⑨生成的高聚物H的结构可知,G为HOOCCH=CHCOOH,该反应为缩聚反应,则D为NaOOCCH=CHCOONa,A系列转化得到G,反应③、④中有一反应是与HCl加成,应是保护碳碳双键,防止被氧化,则反应③为A与HCl发生的加成反应,则B为HOCH2CH2CHClCH2OH,B发生氧化反应生成C为HOOCCH2CHClCOOH,C发生卤代烃的消去反应、中和反应得到D,D酸化生成G。
(1)由上述分析可知,反应①属于加成反应,反应⑤属于消去反应,反应⑧属于取代反应,
故答案为:加成反应;消去反应;取代反应;
(2)反应②的化学方程式是 +2NaOH
+2NaOH![]()
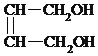 +2NaBr,
+2NaBr,
故答案为: +2NaOH
+2NaOH![]()
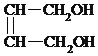 +2NaBr;
+2NaBr;
(3)HOCH2CH=CHCH2OH系列转化得到HOOCCH=CHCOOH,反应③、④中有一反应是与HCl加成,应是保护碳碳双键,防止被氧化,则反应③为A与HCl发生的加成反应,则B为HOCH2CH2CHClCH2OH,B发生氧化反应生成C为HOOCCH2CHClCOOH,
故答案为:③;保护A分子中C=C不被氧化;HOOCCH2CHClCOOH;
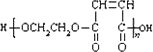
(4)反应⑨为缩聚反应,反应方程式为:nHOCH2CH2OH+nHOOCCH=CHCOOH![]()
 +(2n1)H2O,
+(2n1)H2O,
故答案为:nHOCH2CH2OH+nHOOCCH=CHCOOH![]()
 +(2n1)H2O;
+(2n1)H2O;
(5)G为HOOCCH=CHCOOH,与G具有相同种类和数目的官能团的同分异构体为:CH2=C(COOH)2,
故答案为:CH2=C(COOH)2。


科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
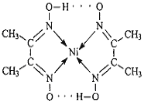
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
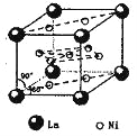
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据要求回答下列问题:
①干冰与 CO2;②白磷与红磷;③3517Cl 与3717Cl;④液氯与氯水;⑤![]() 与
与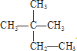 。
。
在上述各组物质中:
互为同位素的是_____________________;
互为同素异形体的是 ______________,
互为同分异构体的是________________;
属于同种物质的是____________________。(填序号,下同)
(2)现有以下六种物质形成的晶体:a.NH4Cl;b.SiO2;c.Na2O2;d.干冰;e.C60;f.Ne
请用相应字母填空:
属于分子晶体的是________; 属于共价化合物的是______________;熔化时只需要破坏共价键的是___; 既含有离子键又含有共价键的是_________; 不存在化学键的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CS2是一种常用的溶剂,CS2的分子中存在___个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是____,键长较长的是____。
(2)SO2与CO2分子的立体结构分别是______和_____,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是________。
(3)醋酸的球棍模型如图1所示。
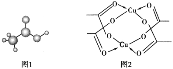
①在醋酸中,碳原子的轨道杂化类型有_____;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是_____(填选项字母)
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置完成系列实验,下列说法正确的是( )

A. 铜和浓硝酸的反应与铜和浓硫酸的反应一样需要加热条件下才能进行
B. BaCl2溶液中会出现白色沉淀BaSO3
C. H2S溶液中会出现黄色沉淀,体现了SO2的还原性
D. 为验证碳、硅非金属性的相对强弱,A试管中的试剂可以是KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为![]()
C. 加入醋酸钠固体,二者的pH均增大
D. 恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1mol/L![]() 与0.1mol/L HCl等体积混合:
与0.1mol/L HCl等体积混合:![]()
B. 0.1mol/L的![]() 溶液,其pH=4,则
溶液,其pH=4,则![]()
C. ![]() 溶液:
溶液:![]()
D. 将0.1mol/L的![]() 溶液和0.1mol/L
溶液和0.1mol/L![]() 溶液等体积混合后,则:
溶液等体积混合后,则:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
A. Al3+、Mg2+、SO![]() B. Mg2+、CO
B. Mg2+、CO![]() 、I-
、I-
C. Al3+、SO![]() 、I- D. Al3+、Br-、SO
、I- D. Al3+、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
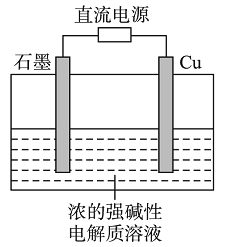
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com