
����Ŀ��������Ϣ��ҵ��̫���ܵ�ع��ת���Ļ������ϡ�п��ԭ���Ȼ�����һ����������Ӧ��ǰ�����Ʊ���ķ��������Ʊ�����ʾ�����£�

��1����̿�ڹ��̢�����______����
��2�����̢��е�Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����Ʊ�Cl2�Ļ�ѧ����ʽ��____��
��3�������Ʊ����̱����ϸ������ˮ��
��SiCl4��ˮ����ˮ������SiO2��һ���ᣬ��Ӧ�Ļ�ѧ����ʽ��_____��
�ڸ���Cl2ʱ���������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ��ǣ��轫Լ90��ij�ʪ��������ȴ��12�棬Ȼ����ͨ�뵽ŨH2SO4�С���ȴ��������____��
��4��Zn��ԭSiCl4�ķ�Ӧ���£�
��Ӧ1�� 400�桫756�� ��SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(l) ��H1<0
Si(s) + 2ZnCl2(l) ��H1<0
��Ӧ2�� 756�桫907�� ��SiCl4(g) + 2Zn(l)![]() Si(s) + 2ZnCl2(g) ��H2<0
Si(s) + 2ZnCl2(g) ��H2<0
��Ӧ3�� 907�桫1410�棬SiCl4(g) + 2Zn(g)![]() Si(s) + 2ZnCl2(g) ��H3<0
Si(s) + 2ZnCl2(g) ��H3<0
�� ��������������Ӧ������˵����������_____��
a�������¶Ȼ����SiCl4��ת���� b����ԭ�������������������н���
c������ѹǿ����߷�Ӧ������ d��Na��Mg���Դ���Zn��ԭSiCl4
�� ʵ���Ʊ�����ѡ������Ӧ3����ѡ���������____��
�� ��֪Zn(l)=Zn(g) ��H = +116 KJ/mol ����SiCl4��ת���ʾ�Ϊ90%��ÿͶ��1mol SiCl4������Ӧ3��������Ӧ2����ų�_____kJ��������
��5���ù�����̫���ܵ��ʱ��Ϊ�������ڹ����ķ��䣬���û�ѧ��ʴ����������γɴֲڵĶ��㡣��ʴ������ϡHNO3��HF�Ļ��Һ������������γ�SiO2�����ת��ΪH2SiF6���û�ѧ����ʽ��ʾSiO2ת��ΪH2SiF6�Ĺ���_____��
���𰸡���ԭ 2NaCl + 2H2O![]() 2NaOH + Cl2��+ H2�� SiCl4+ 2H2O = SiO2+ 4HCl ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų������� b c d �¶ȸߣ���Ӧ���ʿ죻��ǰ������Ӧ�Ƚϣ�������ʹ����� 208��8 SiO2+6HF = H2SiF6+ 2H2O
2NaOH + Cl2��+ H2�� SiCl4+ 2H2O = SiO2+ 4HCl ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų������� b c d �¶ȸߣ���Ӧ���ʿ죻��ǰ������Ӧ�Ƚϣ�������ʹ����� 208��8 SiO2+6HF = H2SiF6+ 2H2O
��������
��1�����ݷ�Ӧ��Ļ�ѧ����ʽ������̿����ԭ����
��2����ⱥ��ʳ��ˮ�Ʊ�Cl2�Ļ�ѧ����ʽ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��3����SiCl4ˮ������SiO2��HCl��
�ڸ���Cl2ʱ���������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ�����ȴ�����á�
��4���� a�������¶ȶ�ƽ���Ӱ�죻 b��п�����ױ�������
c��ѹǿ�����ʵ�Ӱ�죻 d���ӻ�ԭ�ԽǶȷ���
�� �Ա�������Ӧ���ӷ�Ӧ�����Լ�״̬������
�� ��Ӧ�ȵļ����˹���ɵ�Ӧ�á�
��5��SiO2��HF��Ӧ����H2SiF6��
��1��̼��������跴Ӧ����ʽΪSiO2+2C![]() Si+2CO����̼Ԫ���ڷ�Ӧ�л��ϼ����ߣ�����������Ӧ��̼����ԭ���������ԭ��
Si+2CO����̼Ԫ���ڷ�Ӧ�л��ϼ����ߣ�����������Ӧ��̼����ԭ���������ԭ��
��2������Ȼ�����Һ�����������ơ�����������������ʽΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2�������2NaCl+2H2O
2NaOH+Cl2��+H2�������2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��3���ٸ���SiCl4��ˮ����ˮ������SiO2��һ�������Ϣ����Ӧ����SiCl4��ˮ��������Ϊ�������裬������ԭ���غ㣬ˮ����ǰ��ϵ��Ϊ2��������ԭ�Ӻ���ԭ���غ㣬��һ����Ϊ�Ȼ��⣬�Ȼ���ǰ��ϵ��Ϊ4����ѧ��Ӧ����ʽΪSiCl4+2H2O�TSiO2+4HCl���ڳ�ʪ�����к��н϶��ˮ����������ȴ��12�棬��ʱʹˮ����������Ȼ����ͨ�뵽ŨH2SO4�У�����Ũ�����ˮ�����ˣ���֤Ũ�����������ˮ�ԣ�ˮ��Ũ�������÷��ȣ����Խ��������ˮ���ˣ��ܽ��ͷų��������������SiCl4+2H2O�TSiO2+4HCl����ʹˮ�������������ٽ���Ũ�����ˮ�������ֳ�������ˮ�ԣ������ͷų���������
��4���ٶ���������Ӧ����H��0����ʾ���Ƿ��ȷ�Ӧ��a�������¶ȣ�ƽ�������ȵķ����ƶ������Իή��SiCl4��ת���ʣ�a����b��Si�������ڸ��µ������·�Ӧ���ɶ������裬���Ի�ԭ�������������������н��У�b��ȷ��c��������μӵķ�Ӧ������ѹǿ���ܼӿ췴Ӧ�����ʣ�����������Ӧ������������룬��������ѹǿ������߷�Ӧ�����ʣ�c��ȷ��d��Na��Mg���ǻ�ԭ�ԱȽ�ǿ�Ľ��������Դ���Zn��ԭSiCl4��d��ȷ����ѡ��bcd���ڷ�Ӧ2�뷴Ӧ1�Ƚϣ���Ӧ2����Ϊ���������ȷ�Ӧ1�����ڷ��룬��Ӧ3�뷴Ӧ2�Ƚϣ���Ӧ�ﶼΪ��̬���¶ȸߣ���Ӧ���ʸ��죬����ʵ���Ʊ�����ѡ������Ӧ3�����¶ȸ߷�Ӧ���ʿ죻��ǰ������Ӧ�Ƚϸ�����ʹ����룬����¶ȸ߷�Ӧ���ʿ죻��ǰ������Ӧ�Ƚϸ�����ʹ����룻��ÿͶ��1mol SiCl4����2molZn�μӷ�Ӧ������Ӧ3��������Ӧ2���Ƚϣ���Ӧ2��пΪҺ̬������Zn��l���TZn��g����H=+116KJ/mol����SiCl4��ת���ʾ�Ϊ90%������Ӧ3��������Ӧ2����ų�116KJ/mol��2��90%=208��8KJ�����208��8��
��5���������������ᷴӦ��SiO2+4HF=SiF4��+2H2O��SiF4+2HF=H2SiF6��������ϡHNO3��HF�Ļ��Һ������������γ�SiO2�����ת��ΪH2SiF6�Ļ�ѧ����ʽΪSiO2+6HF�TH2SiF6+2H2O�����SiO2+6HF�TH2SiF6+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
(1)���ķ���ϩ��Ʒ����Ϊ���ط�������������ճ��Ϳ�㡣����һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��塣��ͨ��____�������־��塢����ͷǾ��塣
(2)��̬��(Sb)ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]-(������)��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
(3)����(H3BO3)���ķ������(NH4BF4)��������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____(��Ԫ�ط���)��
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A.���Ӽ� B.���� C.���� D.��λ�� E.���»���
(4)ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪNA���þ�����ܶ���=____g/cm3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�ͺ���2.4��10��3mol�����ijŨ������ȫ��Ӧ�����ռ�����״�����������22.4 mL���μӷ�Ӧ��ͭ��������(����)
A. 38.4��10��3gB. 44.8��10��3gC. 48.3��10��3gD. 57.6��10��3g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ�õ�����ϩ�� 1��3-����ϩΪԭ�ϣ��������з�Ӧ�ϳɸ߷��ӻ����� H�������ʿ����������Բ�����άΪ���ϵ���ǿ���ϣ��׳Ʋ����֣���

�밴Ҫ����գ�
(1)д�����з�Ӧ�ķ�Ӧ���ͣ���Ӧ��____________ ����Ӧ�� _______________����Ӧ��_____________________
(2)��Ӧ�ڵĻ�ѧ����ʽ�� ____________________
(3) ��Ӧ�ۡ�������һ��Ӧ���� HCl �ӳɣ��÷�Ӧ��__________���Ӧ��ţ��������һ����Ӧ��Ŀ����_______________________������ C �Ľṹ��ʽ��____________________ ��
(4)��Ӧ��Ļ�ѧ����ʽ�� _______________
(5)д���� G ������ͬ�������Ŀ�Ĺ����ŵ�ͬ���칹�壺_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����в�����SO2��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������SO2��NO��ͬʱ��� Na2S2O4�� NH4NO3��Ʒ�Ĺ�������ͼ���£�CeΪ��Ԫ�أ���

��ش��������⣮
��1��װ������NO����������������NO2-�����ӷ���ʽ______��
��2�����������H2SO3��![]() ��
��![]() ��������SO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������������ҺpH�Ĺ�ϵ��ͼ1��ʾ��
��������SO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������������ҺpH�Ĺ�ϵ��ͼ1��ʾ��
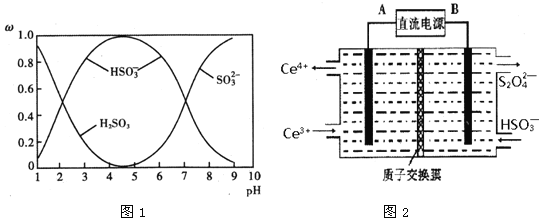
������˵����ȷ����______�����ţ���
A��pH=7ʱ����Һ��c��Na+��=3c��![]() ��
��
B����ͼ�����ݣ����Թ����H2SO3�ĵڶ�������ƽ�ⳣ��Ka2��10-7
C��Ϊ��þ����ܴ��� NaHSO3��Ӧ����Һ��pH������ 4��5Ϊ��
D��pH=9ʱ��Һ��c��OH-��=c��H+��+c��![]() ��+c��H2SO3��
��+c��H2SO3��
����1L1mol/L��NaOH��Һ��ȫ����13.44L������£�SO2����Ӧ�������ӷ���ʽΪ______��
��ȡװ�����е�����ҺVmL����cmol/L�����Ը��������Һ�ζ������Ը��������ҺӦװ��______��������ʽ��������ʽ�����ζ����У��жϵζ��յ�ķ�����______
��3��װ����������֮һ������Ce4+����ԭ����ͼ2��ʾ��ͼ��AΪ��Դ��______�������������������������Ҳ෴Ӧ���з�������Ҫ�缫��ӦʽΪ______��
��4����֪����װ��������Һ��NO2-��Ũ��Ϊ 0.4mol/L��Ҫʹ 1m3����Һ�е�NO2-��ȫת��Ϊ NH4NO3����������װ������ͨ���״���µ� O2�����Ϊ______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�İ뵼����ϣ�Ӧ���ں��պ����ء�����ͨѶ������һ���ᴿ���������Ʒ����Ҫ��GeO2��As2O3���Ĺ������£�
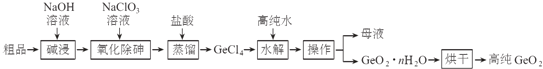
��֪���١�����������еķ�ӦΪ��
GeO2+2NaOH=Na2GeO3+H2O
As2O3+2NaOH=2NaAsO2+H2O
�ڡ������������еķ�ӦΪ��Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
��GeCl4���۵�Ϊ-49.5����AsCl3��GeCl4�ķе�ֱ�Ϊ130.2����84����
��1�����ԭ������Ϊ32������Ԫ�����ڱ��е�λ��Ϊ�� ______ ���� ______ �壮
��2���������������Ĺ����ǽ�NaAsO2����ΪNa3AsO4���䷴Ӧ����ʽΪ�� ______ ��
��3����ͳ���ᴿ�����ǽ���Ʒֱ�Ӽ���������������ȱ���� ______ ��
��4����ҵ�������������ص��豸�� ______
A������ B��������ȡ�� C�������� D����ѹ���˻�
��5����ˮ��������ʱ�����Ļ�ѧ��Ӧ����ʽΪ ______ ����ˮ��������ʱ���ֽϵ��¶���������߲��ʣ�������ܵ�ԭ���� ______ ����һ�����ɣ���
��6����1�ֶ��������Ʒ��������30%�����ᴿ��0.745�ֵĸߴ����������Ʒ���������ѳ���Ϊ ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Co)���仯�����ڹ�ҵ�Ϲ㷺Ӧ���ڴ��Բ��ϡ���ز��ϼ���Ӳ���ϵ�����ijѧϰС������ij��ҵ�����л����ܣ���ƹ����������£�(�����к���Al��Co2O3 ��Fe2O3������)��
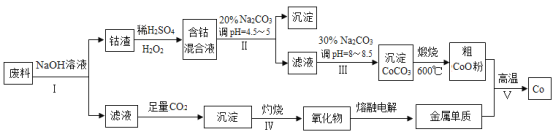
��ش�
��1��������NaOH��Һ����ǰͨ���Ƚ����Ϸ��飬��Ŀ����____________��
��2����������ϡH2SO4��H2O2��Һ��Co2O3��Ӧ���ﵽ�����ܵ�Ŀ�ģ���д���÷�Ӧ�����ӷ���ʽ___________����ʵ����ģ�ҵ����ʱ��Ҳ������������ܣ���ʵ�ʹ�ҵ�����в������ᣬ�����������������ܵ���Ҫԭ��______________��
��3��̼������Һ�ڹ��̢�͢�����������������ͬ����д��̼�����ڹ��̢��з�����Ӧ���ɳ��������ӷ���ʽ__________________________________��
��4�� ����ʵ��������ɹ��̢��������������__________________�����������ƣ������գ�д���ڹ��̢��з�����Ӧ�Ļ�ѧ����ʽ__________________________________��
��5����1.0��10-3 mol/LCoSO4��1.2��10-3mol/L��Na2CO3�������ϣ���ʱ��Һ�е�Co2+��Ũ��Ϊ__________ mol/L������֪��CoCO3���ܶȻ�Ϊ��Ksp=1.0��10-13��
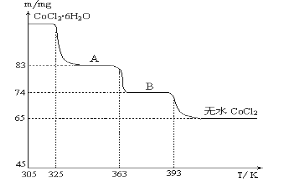
��6��CoO�����ᷴӦ�ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2������ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ����ͼ�Ƿۺ�ɫ��CoCl2��6H2O�����ں��������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�����A�Ļ�ѧʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1 mol��L-1 NaOH��Һ��ε���10 mL 0.1 mol��L-1 NH4HSO4��Һ�У���Һ��pH��NaOH��Һ�����ϵ��ͼ��ʾ��
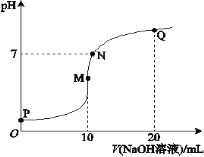
���й�ϵ�У�����ȷ����
A.M��c(Na+)��c(![]() )
)
B.N��c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q��c(![]() )+c(NH3��H2O)=c(Na+)
)+c(NH3��H2O)=c(Na+)
D.M��N��Q�����У�ˮ�ĵ���̶�M��N��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һϡ�����ϡ����Ļ���ᣬ����H2SO4��HNO3�����ʵ���Ũ�ȷֱ���4mol��L��2mol��L��ȡ10mL�˻���ᣬ�����м�����������ۣ�����Ӧ�����ɲ�����״������������Ϊ���跴Ӧ��HNO3����ԭ��NO���� ��
A. 0.448LB. 0.672LC. 0.896LD. 0.224L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com