
【题目】有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
A. 0.448LB. 0.672LC. 0.896LD. 0.224L
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
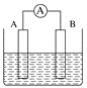
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
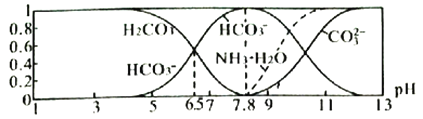
A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是
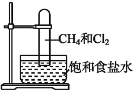
A. 此反应无光照也可发生
B. 甲烷和Cl2反应后的产物只有CH3Cl和HCl
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出醋酸的电离方程式:_____________________________________;
(2)写出醋酸电离平衡常数表达式:_______________;
(3)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(H+)_______(填“增大”、“减小”或“不变”);
(4)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
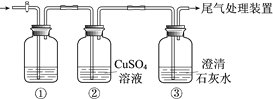
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
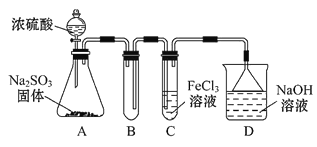
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完成下列反应的化学方程式:(注明反应的条件,并配平方程式)
①实验室制乙炔:_________
②向苯酚钠溶液中通入二氧化碳气体:________
③甲苯与氯气在光照条件下反应生成一氯取代产物:___
(2)有机物A的结构简式为
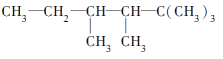
①若A是单烯烃与氢气加成后的产物,则该单烯烃可能有____种结构(不考虑立体异构);
②若A是炔烃与氢气加成后的产物,则此炔烃可能有____种结构;
③若A的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,有顺、反两种结构。
写出A的该种同分异构体(包括顺反异构)的结构简式______、_____;
(3)C5H12O的同分异构体有____种,其中属于醇类且能被氧化成醛的有____种,能消去H2O生成烯的醇有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com