
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
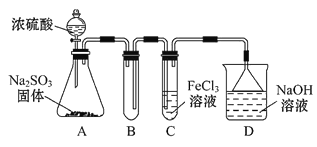
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 不合理 HNO3可以将SO2氧化成H2SO4,干扰实验 BC
【解析】
装置A中的分液漏斗中的浓硫酸滴入锥形瓶中反应生成二氧化硫气体,通过装置B为安全瓶,通过装置C中的氯化铁溶液具有氧化性能氧化二氧化硫为硫酸,氯化铁被还原为氯化亚铁,最后过量的二氧化硫被氢氧化钠溶液吸收,据此分析解答。
(1)利用Fe3+具有强氧化性,C中发生离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42+4H+,Fe3+显棕黄色,Fe2+显浅绿色,现象为溶液由棕黄色变成浅绿色;
(2)HNO3具有强氧化性,能把SO2氧化成H2SO4,干扰实验,因此该做法不合理;
(3)A、浓硫酸与SO2不发生反应,浓硫酸不能代替FeCl3,故A不符合题意;B、酸性高锰酸钾溶液具有强氧化性,如果紫红色褪去,说明SO2具有还原性,故B符合题意;C、碘水中I2,具有氧化性,能把SO2氧化,淡黄色褪去,说明SO2具有还原性,故C符合题意;D、NaCl溶液不与SO2发生反应,不能鉴别SO2有还原性,故D不符合题意。答案选BC。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的氮、氧元素电负性由小到大的顺序是___;基态硫原子的价电子排布式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为____(填化学式)。1 mol CN-中含有的π键的数目为____。
(3)蛋白质分子中氨基(—NH2)氮原子的轨道杂化类型是_____;血液中有一种含铜的呈蓝色的蛋白质分子,与Cu同周期且最外层电子数相等的元素还有______(填元素符号)。
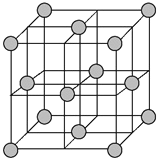
(4)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=___g·cm-3(列出计算式即可)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
A. 0.448LB. 0.672LC. 0.896LD. 0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是

A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用下图所示装置。请回答下列问题
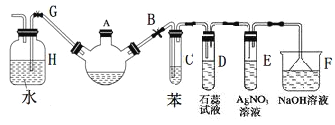
(1)关闭G夹,打开B夹,从装有少量苯的三颈烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生的主要反应的化学方程式为_________________________________。
(2)试管C中苯的作用是:____________________。试管D中出现的现象是:_____________。试管E中出现的现象是:___________________。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时打开G夹,关闭B夹,可以看到的现象是_______________ 。
(4)三颈烧瓶中的溴苯经过下列步骤分离提纯:
①向三颈烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是__________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______。
④经过上述分离操作后,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D是食品中的常见有机物,A是生物的主要供能物质。以A和水煤气(CO、H2)为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知E是CO和H2以物质的量之比1:2反应的产物,F为具有特殊香味、不易溶于水的油状液体。

请回答:
(1)有机物D中含有的官能团名称是______。
(2)B→C化学方程式是______。
(3)下列说法不正确的是______(填字母)。
A.有机物B与金属钠反应比水与金属钠反应要剧烈
B.除去F中含有D、E杂质可用NaOH溶液洗涤、分液
C.D和E反应生成F时,浓硫酸主要起强氧化剂作用
D.C在一定条件下可以与H2反应转化为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:①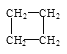 ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤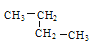 ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 _______种,其中________(结构简式)在苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是

A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为 ___________________。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是 __________________(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com