
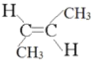
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:①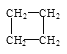 ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤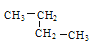 ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 _______种,其中________(结构简式)在苯环上的一溴代物只有两种。
【答案】: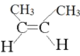
 ④⑤②③ ③①⑥ 4
④⑤②③ ③①⑥ 4 ![]()
【解析】
(1)C=C双键不饱和的C原子上连接不同的原子或基团,具有顺反异构,相同原子或基团在双键平面同一侧时为顺,在异侧时为反,所以顺-2-丁烯的结构简式如图所示: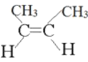 ,反-2-丁烯的结构简式为
,反-2-丁烯的结构简式为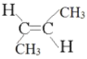 ;
;
(2)在烷烃中,碳原子数越少,沸点越低,在含有相同碳原子数的烷烃中,支链越多,沸点越低,故沸点按由高到低的顺序排列正确的是④⑤②③;等质量的烃CnHm,m/n比值越大,耗氧量就越多,①C4H8中m/n比值为2/1、③C2H6中m/n比值为3/1、⑥C8H8中m/n比值为1/1,所以等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序③①⑥。
(3)分子式为C8H10的芳香烃,分子中含有1个苯环,侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种,故符合条件的结构共有4种,
乙苯![]() 苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
邻二甲苯![]() 的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
对二甲苯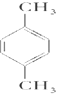 的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
间二甲苯![]() 的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
故答案为:4;![]()


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使酸性高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成饱和烃Z, Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科
(1)从氯化钾溶液中得到氯化钾固体,常用的方法是______________。
(2)从碘水中分离出碘,实验方法的名称为____________,该方法主要实验仪器是____。
(3)现有A、B两种有机物的液态混合物,如果A、B互溶,且相互不发生化学反应,在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
①分离上述A、B的混合物,常用的方法是______;
②如图是某同学设计的分离A、B混合物的操作示意图,请在其冷凝管处标上进出水方向(用箭头↑表示)______;蒸馏烧瓶内碎瓷片的作用是______。
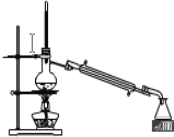
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在元素周期表中的相对位置如下图所示,其中Z元素原子之间通常形成Z2分子。下列说法不正确的是( )
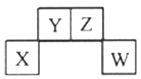
A. X元素的单质既能与强酸反应也能与强碱反应
B. Y元素形成的氢化物在常温下不一定为气体
C. W元素的最高价氧化物对应水化物一定为强酸
D. 由Y、Z、W三种元素形成的二元化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是___________;
![]()
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________________;
(3)Se原子序数为___________,其核外M层电子的排布式为___________;
(4)H2Se的酸性比H2S_____________(填“强”或“弱”)。气态SeO3分子的立体构型为___________。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对氨水溶液中存在的电离平衡NH3·H2O ![]() NH4++OH-叙述正确的是( )
NH4++OH-叙述正确的是( )
A. 加水后,溶液中n(OH-)增大
B. 加入少量浓盐酸,溶液中c(OH-)增大
C. 加入少量浓NaOH溶液,电离平衡正向移动
D. 加入少量NH4Cl固体,溶液中c(NH4+)减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
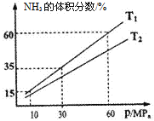
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________T2(填“>”、“<”或“=”)。
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) ![]() 2N*;H2(g)
2N*;H2(g) ![]() 2H*(慢反应)
2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H*
NH*;NH*+H* ![]() NH2*;NH2* +H*
NH2*;NH2* +H* ![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com