
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
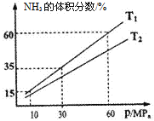
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________T2(填“>”、“<”或“=”)。
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) ![]() 2N*;H2(g)
2N*;H2(g) ![]() 2H*(慢反应)
2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H*
NH*;NH*+H* ![]() NH2*;NH2* +H*
NH2*;NH2* +H* ![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为_________。
【答案】391 AD 0.037 < > 活化能越大,一般分子成为活化分子越难,反应速率越慢 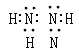
【解析】
利用化学键的键能数据来计算焓变,可规定吸热为正,放热为负,进行代数和。合成氨是一个正向放热的、气体分子数减小的反应,低温和加压对提高氨气的产率有利;看平衡图像时,可采用“定一议二”的方式进行,固定压强不变,看温度对氨气的含量的影响。
(1)设断开1 mol N-H键所需要的能量是xkJ,则依据N2(g)+3H2(g) ![]() 2NH3(g) △H-92kJmol-1。,有946+436×3-6x=-92,解得x=391;
2NH3(g) △H-92kJmol-1。,有946+436×3-6x=-92,解得x=391;
(2)合成氨反应是一个正向放热的反应,所以降温有利于提高产率;合成氨反应是一个正向气体分子数减小的反应,加压有利于提高产率;
(3) ① N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
初始 1 3 0
变化 x 3x 2x
平衡 1-x 3-3x 2x
60%=![]() ,解得x=0.75mol,所以平衡时N2的物质的量分数为0.1,H2的物质的量分数为0.3,NH3的物质的量分数为0.6,所以Kp=
,解得x=0.75mol,所以平衡时N2的物质的量分数为0.1,H2的物质的量分数为0.3,NH3的物质的量分数为0.6,所以Kp=![]() =0.037;
=0.037;
②从图像来看,当压强不变时,T1时NH3的体积分数大于T2时,根据该反应是放热反应,NH3是生成物的特点,确定T1相对于T2来说是降温,即T1<T2;
(4)由题给信息知,第一步反应慢,第2步反应快,而反应越快,说明其活化能越小,所以第一步反应的活化能大于第2步反应的活化能;
(5)肼(N2H4)又称为联氨,其中氮和氮之间形成单键,肼分子的电子式为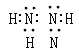 。
。


科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比) 后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是______(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度 C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器
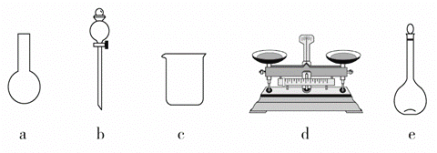
②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制230mL 2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:①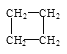 ②
②![]() ③乙烷④正戊烷⑤
③乙烷④正戊烷⑤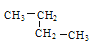 ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 _______种,其中________(结构简式)在苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
又知:![]()

![]() ,
,![]()

 ;
;
判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. HCl中H—Cl 键比H2O中H—O键稳定
D. 由题中所提供信息判断氯元素的非金属性比氧元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列描述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1molL﹣1
C.标准状况下,11.2L四氯化碳所含分子数为0.5NA
D.常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是
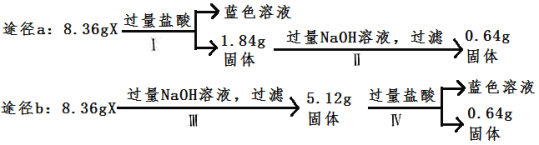
A. 由图可知X中一定存在Fe2O3
B. 不可以判断混合物中是否含有Al2O3
C. 混合物X中含0.64gCu
D. Ⅰ中发生的反应的离子方程式为Cu+2H+=Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸钠粉末,pH增大,溶液漂白性减弱
D. 光照过程中,有气泡冒出,溶液的导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示小麦开花数天后测定种子中主要物质的变化,请据图回答下列问题:

(1)成熟小麦种子中主要的营养物质是________。
(2)检测还原糖的试剂是________,还原糖的多少可通过________来判断。
(3)小麦种子成熟过程中,胚乳里蔗糖与还原糖含量比较,两者的变化趋势________________(填“相同”或“不同”)。
(4)种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为验证磷酸化酶是否是蛋白质,实验过程中实验组试管加入________,对照组试管中加入2 mL豆浆,然后加入等量的________,如果均出现________现象,则证明磷酸化酶是蛋白质。
(5)播种等量的小麦种子和花生种子,________种子需要浅播,因为该种子中_______化合物含量多,该化合物元素组成特点是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com