
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是
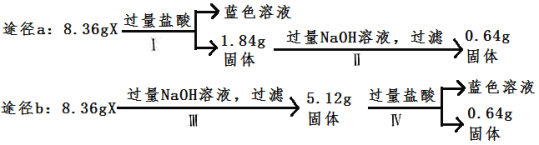
A. 由图可知X中一定存在Fe2O3
B. 不可以判断混合物中是否含有Al2O3
C. 混合物X中含0.64gCu
D. Ⅰ中发生的反应的离子方程式为Cu+2H+=Cu2++H2↑
【答案】A
【解析】
根据途径a可知混合物中含有铜和硅,且能够计算出硅的质量;根据途径b可知,混合物中含有氧化铁,且根据质量守恒,计算出混合物中含有的氧化铁、铜的质量,最后能够计算出氧化铝的质量,据此思路进行解析。
根据途径b可知,混合物X加入过量的强碱溶液,生成偏铝酸钠溶液、硅酸钠溶液,过滤后剩余的固体为5.12克,若全为铜,则固体加入盐酸后,铜不反应,剩余固体仍为5.12克,而实际为0.64克,所以5.12克固体中一定含有Fe2O3和铜;设Fe2O3为xmol, Cu为ymol,根据反应Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Cu=2FeCl2+CuCl2可知,消耗铜的量为xmol,剩余铜的量为0.64/64=0.01mol,所以:160x+64y=5.12,y-x=0.01,解之得:x=0.02 mol,y=0.03mol;根据途径a可知,混合物X加入过量的盐酸溶液,剩余固体为Cu、SiO2,加入足量的强碱溶液,只有SiO2与强碱溶液反应生成硅酸盐,铜不反应,所以剩余铜为0.64/64=0.01mol,所以二氧化硅的质量为1.84-0.64=1.2g,所以氧化铝的质量为:8.36-1.2-0.03×64-0.02×160=2.04g;
A. 根据以上分析可知, X中一定存在Fe2O3,A正确;
B. 根据以上分析可知,原混合物中含有Al2O3,B错误;
C. 根据以上分析可知,混合物X中含0.03×64=1.92gCu,C错误;
D. 铜和盐酸不反应,D错误;
综上所述,本题选A。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 水晶、玛瑙、硅胶、硅石的主要成分都是SiO2
C. SiO2很稳定,与所有的酸都不反应
D. 单质硅可以用于计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)写出⑦元素名称_________,表中能形成两性氢氧化物的元素是__________(填元素符号)。
(2)画出⑥的离子结构示意图___________,写出②含有10个中子的核素的化学符号_________。
(3)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_________________________________。
(4)①②⑥⑧四种元素能组成多种盐(每种盐中都只含有这四种元素),写出其中两种盐溶液能发生反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+CO2(g)=2CO(g),下列措施能使其反应速率减小的是
A. 适当减少木炭的量 B. 将木炭块变为木炭粉
C. 加热反应物 D. 扩大反应容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的认识正确的是
A. 第IA 族元素又可称为碱金属元素 B. 每一族只有一列
C. 0 族元素的原子最外层均有8 个电子 D. 前3 个周期为短周期、其余为长周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com