
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

【答案】 1s22s22p63s23p63d104s1 C<O<N 同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素 sp2 5 CuO Cu2O Cu2O中Cu原子d轨道为全满状态,比较稳定
【解析】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等,因此A是H。B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,B是C;D原子L电子层上有2对成对电子,D是O,所以C是N;E+原子核外有3层电子且各层均处于全满状态,所以E的原子序数是29,为Cu,据此解答。
根据以上分析可知A是H,B是C,C是N,D是O,E是Cu。则
(1)铜元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1。
(2)由于同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N。
(3)C2H4分子为平面形结构,C原子轨道的杂化类型为sp2;由于单键都是σ键,双键中还含有1个σ键,所以1mol乙烯分子中含5molσ键;
(4)铜的半径大于氧,所以实心原子为铜。根据均摊法,甲晶胞中铜原子有4个,氧原子数8×1/8+4×1/4+2×1/2+1=4,所以甲为CuO。乙晶胞中铜原子有4个,氧原子数8×1/8+1=2,所以乙为Cu2O;高温时,甲易转化为乙的原因为Cu2O中Cu为+1价,原子d轨道为全满状态,比较稳定。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
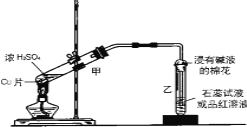
(1)写出甲装置中发生的主要反应的化学方程式____________________________。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________________________。
(3)生成的气体使品红溶液的颜色______________;实验完毕后,取少量乙试管中溶液于试管中加热,现象是________________;原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,有关试剂的保存方法错误的是( )
A. 烧碱溶液保存在带玻璃塞的试剂瓶中B. 液溴用水封保存
C. 少量金属钠保存在煤油中D. 浓硝酸保存在棕色细口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为______________。
(2)A与溴的四氯化碳溶液反应的化学方程式为_________________________________,反应类型是________。
(3)已知:![]()
![]()
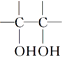 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式:_____________________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_________________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)

请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是
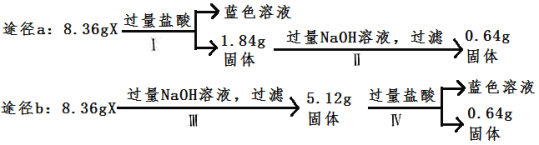
A. 由图可知X中一定存在Fe2O3
B. 不可以判断混合物中是否含有Al2O3
C. 混合物X中含0.64gCu
D. Ⅰ中发生的反应的离子方程式为Cu+2H+=Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
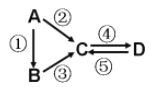
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式:__________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:_____________________________________________________。
(3)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:_________________________________________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据凤凰网2018 年2 月1日报道:中科院研发出世界最强氘氚中子源,下列有关说法正确的是
A. 氘、氚是两种不同的元素 B. 氘、氚的中子数分别为1、2
C. 氘、氚核外电子数不同 D. 中子带正电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com