
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
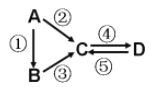
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式:__________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:_____________________________________________________。
(3)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:_________________________________________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:_____________________________________。
【答案】NaOH+CO2=NaHCO3 4NH3+5O2![]() 4NO+6H2O 2Fe3++Fe=3Fe2+ AlO+CO2+2H2O=Al(OH)3↓+HCO3-
4NO+6H2O 2Fe3++Fe=3Fe2+ AlO+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
根据题干信息及转化关系图分析各种物质的组成,再根据物质的性质书写化学方程式及离子方程式。
(1)若B是淡黄色固体,根据题干信息及转化关系知A为Na,C为氢氧化钠,D为碳酸氢钠,反应④的化学方程式:NaOH+CO2=NaHCO3;
故答案为:NaOH+CO2=NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,则B为NH3,C、D为NO、NO2,反应③的化学方程式:4NH3+5O2![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A是应用最广泛的金属,则A为铁,根据题干信息及转化关系知C为氯化铁,反应②⑤均用到的非金属单质是氯气,反应④是氯化铁与铁反应生成氯化亚铁,离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(4)若D物质具有两性,反应②③均要用强碱溶液,则A为Al,D为Al(OH)3,引起温室效应的主要气体为CO2,反应④是偏铝酸钠与二氧化碳的反应,离子方程式:AlO+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO+CO2+2H2O=Al(OH)3↓+HCO3-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱核磁共振、X射线行射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______,Cr的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是______,其中S的杂化类型有_______。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______,原因是______。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____(用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线行射分析其晶胞结构如图所示。

①晶胞中Na堆积形成___________(填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________。
②已知晶胞边长为anm,晶胞中Na的半径为bnm,则He的半径为_____nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)写出⑦元素名称_________,表中能形成两性氢氧化物的元素是__________(填元素符号)。
(2)画出⑥的离子结构示意图___________,写出②含有10个中子的核素的化学符号_________。
(3)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_________________________________。
(4)①②⑥⑧四种元素能组成多种盐(每种盐中都只含有这四种元素),写出其中两种盐溶液能发生反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 非金属原子间只能形成共价键
B. 非金属原子间不可能形成离子化合物
C. 离子化合物中可能有共价键
D. 共价化合物中可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应C(s)+CO2(g)=2CO(g),下列措施能使其反应速率减小的是
A. 适当减少木炭的量 B. 将木炭块变为木炭粉
C. 加热反应物 D. 扩大反应容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C三种短周期元素。A—离子的电子层结构和氖原子相同;短周期元素中B的最高价氧化物对应的水化物碱性最强;C的最外层电子数是其内层电子数的3倍。试推断:
(1)这三种元素分别是:A______、B______、C______;(用元素符号表示)
(2)请写出A—的离子结构示意图__________;
(3)B与C形成的化合物B2C2中含有的化学键类型有_______________;
(4)B元素的最高价氧化物对应的水化物与足量硫酸溶液反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,下列说法不正确的是
2SO3(g)△H<0,下列说法不正确的是
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com