
【题目】下列叙述正确的是 ( )
A. 非金属原子间只能形成共价键
B. 非金属原子间不可能形成离子化合物
C. 离子化合物中可能有共价键
D. 共价化合物中可能有离子键
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是
A. Mg和Cu B. Na和Fe C. Al和Mg D. Zn和Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)

请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。

回答下列问题:
(1)A的电子式是_________;已知C是反式产物,则C的结构简式为_________。
(2)⑥的反应类型是_________,⑧的反应类型是__________。
(3)F含有的官能团的名称是________。
(4)反应⑤的化学方程式为__________。
(5)肉桂酸( )的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯( )的合成路线___________。
)的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
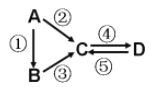
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式:__________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式:_____________________________________________________。
(3)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式:_________________________________________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
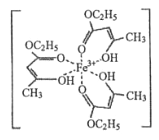
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为________________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
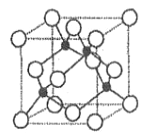
①该化合物的化学式为________________,A原子的配位数是______________。
②该化合物难溶于水,但易溶于氨水,其原因可能是________________;与NH3 互为等电子体的分子有________________(写化学式,一种即可)。 NH3 的键角大于H2O的键角的主要原因是_______________________。
③已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________________pm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在生活和化学实验中有广泛应用。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

(1)步骤Ⅰ中,试剂甲必须具有的性质是________(填序号)。
A.碱性 B.稳定性 C.氧化性 D.还原性
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,写出阳极反应式:_____________________。步骤Ⅲ中,以KClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的KClO3溶液200 mL,该反应的离子方程式为____________________________________________。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气在标准状况下体积范围为________________。工业上可以用实验室制氯气的残余物质溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式:__________________。
(4)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案;
实验 | 20.0 mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 2.0 g | 20℃ | |
Ⅱ | 5% | 1.0 g | 20℃ | |
Ⅲ | 10% | 1.0 g | 20℃ | |
Ⅳ | ω | 2.0 g | 30℃ |
①实验Ⅱ和Ⅲ的结论是____________________________________________________。
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,w=________。本实验待测数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq) AlCl3
AlCl3![]() Al2O3B. NaCl(饱和)
Al2O3B. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3C. N2
Na2CO3C. N2 NO2
NO2![]() HNO3
HNO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com