
【题目】
(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
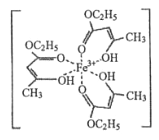
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为________________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
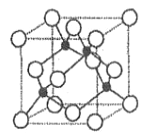
①该化合物的化学式为________________,A原子的配位数是______________。
②该化合物难溶于水,但易溶于氨水,其原因可能是________________;与NH3 互为等电子体的分子有________________(写化学式,一种即可)。 NH3 的键角大于H2O的键角的主要原因是_______________________。
③已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________________pm(列出计算表达式即可)。
【答案】 3d5 sp2、 sp3 CDEGH 分子晶体 CuCl 4 Cu+可与氨形成易溶于水的配位化合物 PH3 NH3、 H2O 分子中 N、 O 原子的孤电子对数分别是 1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小。 ![]()
【解析】(1)①铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5,故答案为:3d5;
②该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化,故答案为:sp2、sp3;
③同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,氢原子和氧原子之间还存在氢键,则该化合物中含有配位键、极性键、非极性键、氢键、σ键和π键,但氢键不是化学键,故选CDEGH;
④三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体,故答案为:分子晶体;
(2)根据价电子排布式判断出A原子为Cl原子;
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×![]() +6×
+6×![]() =4,故化学式为CuCl,根据图示,铜原子周围有4个氯原子距离相等,且最小,即铜原子的配位数为4,则氯原子的配位数也是4,故答案为:CuCl;4;
=4,故化学式为CuCl,根据图示,铜原子周围有4个氯原子距离相等,且最小,即铜原子的配位数为4,则氯原子的配位数也是4,故答案为:CuCl;4;
②Cu+可与氨形成易溶于水的配位化合物,所以CuCl难溶于水但易溶于氨水;该化合物中Cu+被氧化为Cu2+;与NH3 互为等电子体的分子有PH3等;NH3、 H2O 分子中 N、 O 原子的孤电子对数分别是 1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小,使得NH3 的键角大于H2O的键角,故答案为:Cu+可与氨形成易溶于水的配位化合物;PH3;NH3、 H2O 分子中 N、 O 原子的孤电子对数分别是 1、2,孤电子对数越多,对成键电子对的排斥力越强,键角越小;
③1mol晶胞的质量为4×99.5g,1mol晶胞的体积为![]() cm3,则晶胞的边长为
cm3,则晶胞的边长为![]() cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的
cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的![]() ,而体对角线为晶胞边长的
,而体对角线为晶胞边长的![]() 倍,所以铜原子和M原子之间的最短距离为
倍,所以铜原子和M原子之间的最短距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:
×1010pm,故答案为:![]() ×
×![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】据报道,科学家发现了新的氢粒子,这种粒子是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考.对于这种氢粒子,下列说法错误的是( )
A.它的组成可以用H3+表示
B.它比普通氢分子多一个氢原子核
C.它一定含3个中子
D.可以推测它的化学性质与H2不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是

A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中①②③④表示不同化学元素所组成的化合物,以下说法不正确的是
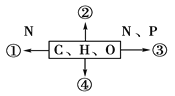
A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②大量存在于皮下和内脏器官周围等部位,则②是脂肪
C. 若③为某种多聚体的单体,且能贮存生物的遗传信息,则③是染色体核糖核苷酸
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
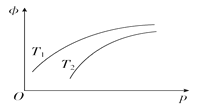
A. T1大于T2
B. 升高温度,该反应的化学平衡常数增大
C. 当n(N2)∶n(H2)∶n(NH3)=1∶3∶2时,反应一定达到平衡状态
D. 其他条件不变,缩小体积增大压强,可提高单位时间内NH3的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
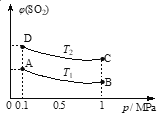
①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为有机物之间的转化关系。
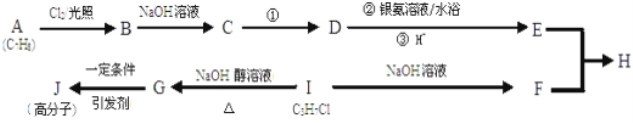
已知:E属于芳香族化合物;F的核磁共振氢谱为三组峰,且面积比为6:1:1。
请回答下列问题:
(1)B的结构简式为__________。F的名称为__________,
(2)C中官能团的名称为__________,G→J的反应类型__________,发生反应①的条件是_______________。
(3)反应B→C的化学方程式为__________。
(4)E的一种同系物X比E的相对分子质量大14;X同分异构体有很多种。
①若X的同分异构体为芳香族化合物,它与E具有相同的官能团,则符合此条件的X的同分异构体有__________种。
②若X的同分异构体能与新制氢氧化铜悬浊液反应,生成砖红色沉淀,也能使FeCl3溶液显紫色,且苯环上的一元取代物有两种,则X的这种同分异构体的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com