
【题目】下图中①②③④表示不同化学元素所组成的化合物,以下说法不正确的是
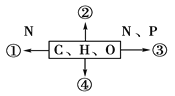
A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②大量存在于皮下和内脏器官周围等部位,则②是脂肪
C. 若③为某种多聚体的单体,且能贮存生物的遗传信息,则③是染色体核糖核苷酸
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
【答案】C
【解析】
根据一些常见化合物的元素组成蛋白质是由C、H、O、N元素构成,有些含有P、S;核酸是由C、H、O、N、P元素构成;脂质是由C、H、O构成,有些含有N、P,如磷脂;糖类是由C、H、O组成。①的组成元素是C、H、O、N,最可能是蛋白质或氨基酸;②和④的组成元素只有C、H、O,可能是糖类或脂肪;③的组成元素是C、H、O、N、P,可能是ATP或核酸或磷脂。
①的组成元素是C、H、O、N,所以①最可能是组成蛋白质的氨基酸,A正确;②的组成元素只有C、H、O,且存在于皮下和内脏器官周围等部位,可能是脂肪,B正确;③的组成元素是C、H、O、N、P,且能储存遗传信息,所有③可能是核酸,C错误;④的组成元素只有C、H、O,且在肝脏和肌肉中贮能,可能是肝糖元和肌糖元,D正确。


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中共有18个纵行,但仅有15个族
C.原子的核外电子层数等于该元素所在的周期数
D.原子最外层电子数等于该元素所在的族序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
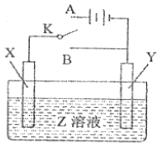
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为铜片,Y为铁片,Z为CuSO4,将开关K置于A处可实现在铁片上镀铜
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为NaOH,将开关K置于A处,Y极发生的反应为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1) 氧化还原法消除NOx的转化如下:
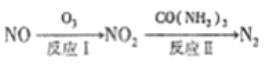
已知: NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则NO 与O3 只生成NO2 的热化学方程式为_____________________。
(2) 有人设想将CO按下列反应除去: 2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____( 填“是”或“否”),依据是_____________________。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000mo1NO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
①结合上表的数据,写出NO与活性炭反应的化学方程式______ 该反应的正反应为_______(填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,再次平衡后,NO 的体积分数将____。(填“增大”、“减小”或“不变”)。
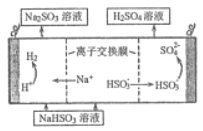
(4) 用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示。请写出开始时阳极的电极反应式______________。
(5)常温下,Ksp(BaCO3) =2.5×10-9,Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) ,该反应平衡常数K的表达式为:K=_______,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
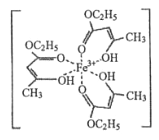
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为________________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
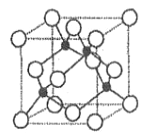
①该化合物的化学式为________________,A原子的配位数是______________。
②该化合物难溶于水,但易溶于氨水,其原因可能是________________;与NH3 互为等电子体的分子有________________(写化学式,一种即可)。 NH3 的键角大于H2O的键角的主要原因是_______________________。
③已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________________pm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金与铁的物理性质的比较如下表所示:
熔点 | 密度 | 硬度 | 导电性 | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
又知该合金耐腐蚀,强度大.从以上性能看,该合金不适合用作( )
A.导线
B.门窗框
C.炉具
D.飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类是广泛存在于植物和动物体内的天然有机化合物,薄荷酵(![]() )和香茅醇(
)和香茅醇( )是两种常见的萜类化合物,有关这两种化合物的说法中正确的是
)是两种常见的萜类化合物,有关这两种化合物的说法中正确的是
A. 薄荷醇环上的一溴代物有5种(不考虑立体异构)
B. 薄荷醇和香茅醇一定条件下都能与乙酸发生取代反应
C. 利用酸性高锰酸钾溶液可鉴别薄荷醇和香茅醇
D. 等质量的香茅醇和薄荷醇完全燃烧,薄荷醇消耗的氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质熔、沸点逐渐降低
B.气态氢化物稳定性逐渐增强
C.卤素离子的还原性逐渐增强
D.元素的非金属性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com