
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1) 氧化还原法消除NOx的转化如下:
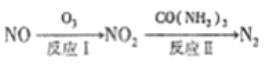
已知: NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
则NO 与O3 只生成NO2 的热化学方程式为_____________________。
(2) 有人设想将CO按下列反应除去: 2CO(g)=2C(s)+O2(g) △H>0,请你分析该反应能否自发进行?_____( 填“是”或“否”),依据是_____________________。
(3)活性炭也可用于处理汽车尾气中的NO。在2L.恒容密闭容器中加入0.1000mo1NO和2.030mol 固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
①结合上表的数据,写出NO与活性炭反应的化学方程式______ 该反应的正反应为_______(填”吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,再次平衡后,NO 的体积分数将____。(填“增大”、“减小”或“不变”)。
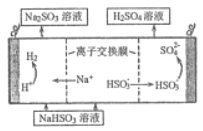
(4) 用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解原理示意图如图所示。请写出开始时阳极的电极反应式______________。
(5)常温下,Ksp(BaCO3) =2.5×10-9,Ksp(BaSO4) =1.0×10-10,控制条件可实现如下沉淀转换:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) ,该反应平衡常数K的表达式为:K=_______,欲用1LNa2CO3 溶液将0.01molBaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于_________。
【答案】 3NO(g)+O3(g)═3NO2(g) △H=-317.1kJ·mol-1; 否 该反应是焓增、熵减的反应,根据 △G=△H-T·△S, △G>0; 2NO(g)+C(s)![]() CO2(g)+N2(g) 放热 不变 HSO3-+H2O-2e-=SO42-+3H+ c(SO42-)/c(CO32-) 0.26 mol/L
CO2(g)+N2(g) 放热 不变 HSO3-+H2O-2e-=SO42-+3H+ c(SO42-)/c(CO32-) 0.26 mol/L
【解析】(1)①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ/mol,②2NO(g)+O2(g)═2NO(g)△H=-116.2kJ/mol,根据盖斯定律,目标反应的反应热等于①+②,所以I的热化学方程式为3NO(g)+O3(g)═3NO2(g)△H=-317.1kJmol-1,故答案为:3NO(g)+O3(g)═3NO2(g)△H=-317.1 kJmol-1;
(2)根据△G=△H-T△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行,2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,根据△G=△H-T△S,△G>0,不能实现,故答案为:否;该反应是焓增、熵减的反应,根据△G=△H-T△S,△G>0;
(3)①根据题意,活性炭也可用于处理汽车尾气中的NO,对于环境的改善有重大意义,因此NO与活性炭反应生成对环境无影响的物质AB,AB应该为二氧化碳和氮气,反应的化学方程式为2NO(g)+C(s)![]() CO2(g)+N2(g),根据表格数据,温度升高平衡逆向移动,所以正反应是放热反应,故答案为:2NO(g)+C(s)
CO2(g)+N2(g),根据表格数据,温度升高平衡逆向移动,所以正反应是放热反应,故答案为:2NO(g)+C(s)![]() CO2(g)+N2(g);放热;
CO2(g)+N2(g);放热;
②200℃时,平衡后向恒容容器中再充入0.1000mo1NO,根据方程式2NO(g)+C(s)![]() CO2(g)+N2(g),相当于增大压强,平衡不移动,再次平衡后,NO的体积分数不变,故答案为:不变;
CO2(g)+N2(g),相当于增大压强,平衡不移动,再次平衡后,NO的体积分数不变,故答案为:不变;
(4)用 NaSO3 吸收 SO2 得 NaHSO3 溶液,然后电解该溶液可制的得硫酸,硫的化合价升高,所以阳极上HSO3-失去电子被氧化生成SO42-,阳极反应的电极反应式为: HSO3-+H2O-2e-=SO42-+3H+,故答案为:HSO3-+H2O-2e-=SO42-+3H+;
(5)CO32-+BaSO4=BaCO3+SO42-;K=![]() =
=![]() =
=![]() =0.04;c(SO42-)=0.01 mol/L,
=0.04;c(SO42-)=0.01 mol/L,![]() ≤0.04,c(CO32-)≥0.25+0.01=0.26mol/L,故答案为:
≤0.04,c(CO32-)≥0.25+0.01=0.26mol/L,故答案为:![]() ;0.26mol/L。
;0.26mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
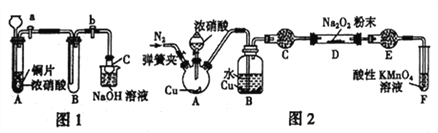
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2 氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A 中反应的离子方程式是____________________________。
②待试管B 中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________。
结论:甲同学认为假设2 正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________。
Ⅱ.该研究性学习小组同学还认为NO 易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O; 酸性条件下,NO 能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________。
②B 中观察到的主要现象是____________(填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色 b.有红棕色气泡产生 C.有无色气泡产生③C、E 中所盛装的试剂不能是________(填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F 中发生反应的氧化剂与还原剂的物质的量之比为_____________。
⑤充分反应后,检验D装置中产物的方法是:______________ ,则产物是NaNO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
【答案】B
【解析】
NO、CO2的混合气体通过足量的Na2O2发生反应有2Na2O2+2CO2═2Na2CO3+O2、2NO+O2═2NO2,问题的关键在于NO与氧气反应存在着三种可能性,一种情况是恰好反应,一种情况是NO过量,另一种情况可能是O2过量,据此讨论计算。
NO、CO2的混合气体通过足量的Na2O2发生反应有(1)2Na2O2+2CO2═2Na2CO3+O2、(2)2NO+O2═2NO2,假设参加反应的CO2为x mL,NO为ymL,则x+y=10,由方程式得以下关系:
①2CO2+ 2Na2O2= 2Na2CO3+ O2
2mL 1mL
xmL ![]() mL
mL
②2NO + O2 = 2NO2
2mL 1mL 2mL
ymL ![]() mL
mL
当反应②恰好反应时,即当y=x时(此时x、y都等于5),生成的NO2的体积为5mL,显然符合题意,A正确;当y>x时,NO有过量,O2反应完,此时反应掉的NO为xmL,则剩余的NO为(ymL-xmL),生成的NO2气体为xmL,因此反应最后得到的混合气体为NO和NO2,其体积和为(ymL-xmL)+xmL=ymL,结合x+y=10,再根据NO过量的前提条件为y>x,可以得出结论y>5,这与题意“气体体积缩小为5mL”不符,B错误;当y<x时,NO不足,O2过量,此时反应掉的O2为![]() mL,剩余的O2为(
mL,剩余的O2为(![]() —
—![]() )mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(
)mL,生成的NO2气体为ymL,因此,反应最后得到的混合气体为O2和NO2,其体积和为:(![]() —
—![]() )mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
)mL+ymL=5mL,这与题意“气体体积缩小为5mL”符合,这表明如果y<x,这种情况都能符合题意,C、D正确,故选B。
【点睛】
本题考查混合物的有关计算,属于讨论型计算,侧重对综合能力的考查,确定反应可能的情况是解答的关键。
【题型】单选题
【结束】
24
【题目】在一定温度和压强下,将一支容积为21mL的试管充满NO2后,倒置于一个盛水的水槽中,当试管内液面上升一定高度不再变化时,在相同条件下再通入O2,若要使试管内的液面仍保持在原高度,则通入O2的体积为
A. 8.75mL B. 12.25mL
C. 5.25mL D. 10.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是______________________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)___________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
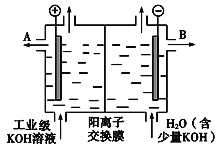
①该电解槽的阳极反应式是_______________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种无色溶液混合后仍然为无色透明溶液,混合后的溶液中可能存在的离子组合为
A.Mg2+、SO42-、K+、Cl-B. Na+、NH4+、NO3-、Fe3+
C. K+、Cu2+、Cl-、Br-D. Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中①②③④表示不同化学元素所组成的化合物,以下说法不正确的是
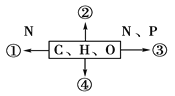
A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②大量存在于皮下和内脏器官周围等部位,则②是脂肪
C. 若③为某种多聚体的单体,且能贮存生物的遗传信息,则③是染色体核糖核苷酸
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是五颜六色的”是指在化学实验中有着丰富多彩的颜色变化。下列有关反应获得的颜色不正确的是( )
①红 ②橙 ③黄 ④绿 ⑤青 ⑥蓝 ⑦紫
A.乙烯气体通入酸性高锰酸钾溶液中:⑦
B.淀粉遇碘:⑥
C.蛋白质遇浓硝酸:③
D.热的氧化铜遇酒精:①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品中含有少量的杂质Na2SO4,按下列流程进行净化,流程中的( )中是合适的试剂,在[ ]中是实验操作名称。写出有关反应的化学方程式:

(1)操作①、②、③、⑤中所需加入试剂分别为_______、______、______、_____。
(2)操作①、④、⑥的操作名称分别为_________、_______、_______。
(3)写出有关的离子反应方程式:
第②步:_____________________________。
第⑤步:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com