
����Ŀ�����ܱ������з�����Ӧ��N2(g)��3H2(g)![]() 2NH3(g)'��H����92.4 kJ��mol��1��NH3��ƽ�������е��������(��)���¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����(����)
2NH3(g)'��H����92.4 kJ��mol��1��NH3��ƽ�������е��������(��)���¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����(����)
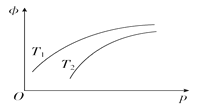
A. T1����T2
B. �����¶ȣ��÷�Ӧ�Ļ�ѧƽ�ⳣ������
C. ��n(N2)��n(H2)��n(NH3)��1��3��2ʱ����Ӧһ���ﵽƽ��״̬
D. �����������䣬��С�������ѹǿ������ߵ�λʱ����NH3�IJ���
���𰸡�D
��������A����ͼ���֪T1ͼ���ʾNH3����������仯����T2ͼ���ʾNH3����������仯�죬����T1���¶�С��T2���¶ȣ���A����B������һ�����ȷ�Ӧ�����������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С������B����C�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ƽ��״̬�أ�����˵����Ӧ�ﵽƽ��״̬����C����D������ѹǿ���ӿ췴Ӧ���ʣ����Ե�λʱ�������ɸ����NH3������D��ȷ��������ȷ��ΪD��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�1���ˮ�����ܽ�500�����HCl���塣����ˮ��ͨ���״���µ�44.8 L HCl�������1 L��Һ������������ȫ�ܽ⣬������Һ�к�HCl�����ʵ���Ũ��Ϊ____________��������Һ�ܶ�Ϊ1.0g/cm3������Һ�к�HCl��������Ϊ________���Ӹ���Һ��ȡ��10 mLŨ�����ܽ���ˮ���Ƴ�250 mL��Һ�����ƺ��ϡ��Һ�к�HCl���ʵ���Ũ��Ϊ________������Ũ������������ϡ����ʱ�����������У�ʹ��ǰ�������Ƿ�©Һ��������________________�����ƹ����У����Ũ��ƫ�͵IJ���������________________(ѡ�����в��������)��
A������ƿ������ˮϴ��δ�Ӹ���
B����Ͳ������ˮϴ��δ����
C�����ձ���Ũ������������ƿ��δ��ˮϴ���ձ�����������ƿ�м�ˮ���̶�
D���ý�ͷ�ι�������ƿ�м�ˮʱ�����������̶��ߣ������⽺ͷ�ιܴ�ƿ������������Һʹʣ����Һ���ɴ�̶���
E������ʱ������Һ���ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ת������Ҫ���뻹ԭ������ʵ�ֵ��ǣ�
A.Cl-����Cl2B.MnO4-����Mn2+
C.NaCl����HClD.CO����CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1���Ȼ�����Һ���ڼ���ʳ���㾫��������ʱ����������ɫ�����������ӽṹ��ͼ��ʾ��
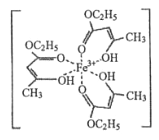
����������У���̬�����ӵļ۵����Ų�ʽΪ________________��
�����������̼ԭ�ӵ��ӻ����������________________��
�����������к��еĻ�ѧ����____________������ĸ����
A. ���Ӽ� B. ������ C. ���Լ� D. �Ǽ��Լ� E. ��λ�� F. ��� G.���� H. ����
���Ȼ����ڳ������ǹ��壬�۵�Ϊ 306�����е�Ϊ 315������ 300������������������ˮ��Ҳ���������ѡ���ͪ���л��ܼ����ݴ��ж��Ȼ����ľ�������Ϊ________________��
��2����̬ A ԭ�ӵļ۵����Ų�ʽΪ 3s23p5��ͭ��A �γɻ�����ľ�����ͼ��ʾ���������ͭԭ�ӣ���
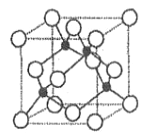
���û�����Ļ�ѧʽΪ________________��Aԭ�ӵ���λ����______________��
���û�����������ˮ���������ڰ�ˮ����ԭ�������________________����NH3 ��Ϊ�ȵ�����ķ�����________________��д��ѧʽ��һ�ּ��ɣ��� NH3 �ļ��Ǵ���H2O�ļ��ǵ���Ҫԭ����_______________________��
����֪�û����ᄃ����ܶ�Ϊ��g��cm-3�������ӵ�������ֵΪ NA����þ����� Cu ԭ�Ӻ�A ԭ��֮�����̾���Ϊ________________pm���г��������ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����з���ʽ������������һ����Ϊͬϵ�����
A. C2H6O��C3H8O B. C6H6O��C7H8O������������
C. C4H8��C3H6 D. C7H8��C8H10������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ㷺������ֲ��Ͷ������ڵ���Ȼ�л���������ɽ�(![]() )����é��(
)����é��( )�����ֳ������������й������ֻ������˵������ȷ����
)�����ֳ������������й������ֻ������˵������ȷ����
A. ���ɴ����ϵ�һ�������5��(�����������칹��
B. ���ɴ�����é��һ�������¶��������ᷢ��ȡ����Ӧ
C. �������Ը��������Һ�ɼ��𱡺ɴ�����é��
D. ����������é���ͱ��ɴ���ȫȼ�գ����ɴ����ĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
(1)��ͼ��N2(g)��H2(g)��Ӧ����1 mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��____________________________________________��

(2)��֪��ѧ���������γɻ��1 mol��ѧ���ų������յ���������λkJ��mol��1������֪�������ݣ�
��ѧ�� | HH |
|
����/kJ��mol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���________kJ��mol��1��
(3)��NH3����ԭNOx���������������������Ⱦ����֪��
4NH3(g)��3O2(g)===2N2(g)��6H2O(g) ��H1����a kJ��mol��1 ��
N2(g)��O2(g)===2NO(g) ��H2����b kJ��mol��1 ��
��1 mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�Ȧ�H3��________ kJ��mol��1(�ú�a��b��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ������ڼ���������ϩ����(����)
A.��ˮB.̼������ҺC.�ƾ���ҺD.���Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ����ͼ��ʾ����ع���ԭ��Ϊ��Fe3++Cr2+ ![]() Fe2++Cr3+������˵����ȷ���ǣ� ��
Fe2++Cr3+������˵����ȷ���ǣ� ��
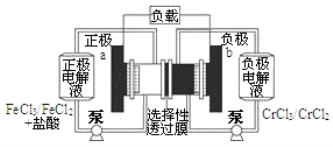
A. ��طŵ�ʱ��Cl����b������ѡ������Ĥ����a��
B. ��طŵ�ʱ��b���ĵ缫��ӦʽΪCr3++e��=Cr2+
C. ��س��ʱ��a���ĵ缫��ӦʽΪFe2+-e��=Fe3+
D. ��س��ʱ����·��ÿͨ��0.1mol���ӣ�Fe2+Ũ�Ƚ���0.1molL��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com