
【题目】下列转化中需要加入还原剂才能实现的是:
A.Cl-——Cl2B.MnO4-——Mn2+
C.NaCl——HClD.CO——CO2
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】常温时,研究pH对一定浓度FeSO4的稳定性的影响,根据下图分析不合理的是:
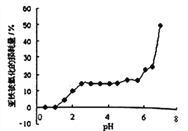
A. pH小于1时,亚铁几乎无损耗,可能的原因是4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+平衡逆向移动
4Fe(OH)3+8H+平衡逆向移动
B. 其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱
C. pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH)2更易被氧化
D. pH在3.0~5.5之间,pH的变化对FeSO4稳定性影响不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
【答案】B
【解析】
Fe(OH)3具有氧化性、I—具有还原性,二者反应生成I2和Fe2+;NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应;酸性条件下溶液中不存在OH-;向FeO中加入稀硫酸,发生复分解反应。
Fe(OH)3具有氧化性、I-具有还原性,二者反应生成I2和Fe2+,离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,A错误;NH4HSO3溶液与足量的NaOH溶液混合加热,足量的NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应,方程式符合客观事实,化学式书写正确,电荷和原子都守恒,B正确;酸性条件下KIO3溶液与KI溶液发生反应生成I2,正确的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,C错误;向FeO中加入稀硫酸, FeO与稀硫酸反应生成硫酸亚铁和水,D错误。本题选B。
【点睛】
题考查了离子方程式的书写,明确物质的性质、离子方程式书写规则即可解答,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
【题型】单选题
【结束】
19
【题目】为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了四种不同的方法,其中不可行的是
A. 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅
B. 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C. 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D. 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3 - |
B | 用洁净的铂丝蘸取某溶液在火焰上灼烧,观察到火焰显黄色 | 该溶液中一定存在Na+,一 定没有K+ |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和 0.1mol/L CH3COONa 溶液的pH | 比较HC1O 和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是

A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
2NH3(g)'ΔH=-92.4 kJ·mol-1,NH3在平衡混合气中的体积分数(φ)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
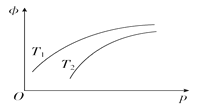
A. T1大于T2
B. 升高温度,该反应的化学平衡常数增大
C. 当n(N2)∶n(H2)∶n(NH3)=1∶3∶2时,反应一定达到平衡状态
D. 其他条件不变,缩小体积增大压强,可提高单位时间内NH3的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
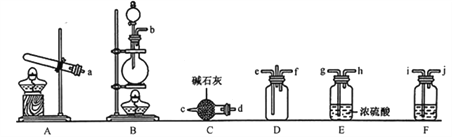
①利用装置A制取实验所需的氨气,写出反应的化学方程式:_______________________。
②该实验中用浓盐酸与MnO2反应制取所需氯气,则装罝F中的试剂是_______________(填写试剂名称)。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:________→-ef←_________(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要___________。
(2)岩脑砂中元素的测定:准确称取a g岩脑砂,与足量的氧化铜混合加热(发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
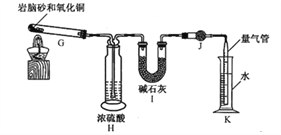
①设置装置H的目的是_____________。
②若装置Ⅰ增重b g,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5 L·mol-1),则岩脑砂中m(N):m(Cl)=_____________(用含b、V的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值_____________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com