
【题目】下列离子方程式书写正确的是
A. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
【答案】B
【解析】
Fe(OH)3具有氧化性、I—具有还原性,二者反应生成I2和Fe2+;NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应;酸性条件下溶液中不存在OH-;向FeO中加入稀硫酸,发生复分解反应。
Fe(OH)3具有氧化性、I-具有还原性,二者反应生成I2和Fe2+,离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,A错误;NH4HSO3溶液与足量的NaOH溶液混合加热,足量的NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应,方程式符合客观事实,化学式书写正确,电荷和原子都守恒,B正确;酸性条件下KIO3溶液与KI溶液发生反应生成I2,正确的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,C错误;向FeO中加入稀硫酸, FeO与稀硫酸反应生成硫酸亚铁和水,D错误。本题选B。
【点睛】
题考查了离子方程式的书写,明确物质的性质、离子方程式书写规则即可解答,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
【题型】单选题
【结束】
19
【题目】为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了四种不同的方法,其中不可行的是
A. 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅
B. 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C. 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D. 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
科目:高中化学 来源: 题型:
【题目】为研究(NH4)2 SO4 和 NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同 浓度的 NaOH 溶液 40.0 mL,加热并完全反应,产生 NH3的体积(已折算成标准状况,
不考虑NH3在水中的溶解)如下表:
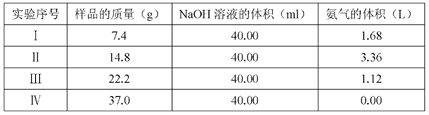
(1)样品中(NH4)2 SO4和NH4HSO4的物质的量之比为_____________。
(2)NaOH 溶液的物质的量浓度为_________________________(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为____________,若得溶液密度为1.0g/cm3,则溶液中含HCl质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________________;配制过程中,造成浓度偏低的操作可能有________________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E.定容时,俯视液面加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的说法中,正确的是( )
A.碱金属单质的密度都比水轻,投入水中都能浮在水面上
B.碱金属单质在氧气中燃烧,产物都是过氧化物
C.碱金属单质的熔沸点一般随着原子的电子层数的增多而升高
D.碱金属单质都是还原剂,其还原性随着核电荷数的增大而增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2g Fe加入一定量的HNO3充分反应后,生成Fe2+、Fe3+的物质的量之比为1:4,将生成的气体与一定量的O2混合后通入水中,最后无气体剩余,则通入的氧气的物质的量是
A. 0.12mol B. 0.14mol
C. 0.2mol D. 0.13mol
【答案】B
【解析】
铁与硝酸反应生成Fe2+、Fe3+和氮的氧化物,氮的氧化物与一定量的O2混合后通入水中,最后无气体剩余,说明氮的氧化物与O2完全反应生成硝酸,铁还原硝酸的量与生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同,据此计算。
由题意可知,铁还原硝酸的量与氮的氧化物与O2完全反应生成硝酸的量相同,即铁失去电子的数目与O2得到电子数目相同。11.2gFe的物质的量为0.2mol,Fe全部溶解,生成Fe2+和Fe3+的物质的量之比为1:4,所Fe2+的物质的量为0.04mol,Fe3+的物质的量为0.16mol,共失去电子为0.04mol×2+0.16mol×3=0.56mol,由得失电子守恒,O2得到电子的物质的量为0.56mol,所以O2的物质的量为0.56mol/4=0.14mol,故选B。
【点睛】
本题考查铁和硝酸反应的有关计算,该题的关键是在明确反应原理的基础上灵活运用电子得失守恒。
【题型】单选题
【结束】
23
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为5mL(相同状况),则CO2和NO的体积比不可能为
A. 1∶1 B. 1∶2
C. 2∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是
A. 60mL B. 45mL
C. 30mL D. 15mL
【答案】C
【解析】
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与0.84L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
NO2、N2O4、NO混合气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)0.0325mol×2=0.075mol,根据Cu原子个数守恒可知Cu(NO3)2为0.075mol;根据 Cu2+—2OH—得NaOH 为 0.075mol×2=0.15 mol,则NaOH,溶液的体积V为0.15 mol/5mol/L=30mL,故选C。
【点睛】
本题主要考查了金属与硝酸反应的计算,根据氧化还原反应中电子得失守恒和原子个数守恒计算是解答的关键。
【题型】单选题
【结束】
26
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________。

(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ·mol-1。若已知下列数据:
化学键 | HH |
|
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1 ②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com