
【题目】铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是
A. 60mL B. 45mL
C. 30mL D. 15mL
【答案】C
【解析】
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与0.84L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
NO2、N2O4、NO混合气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)0.0325mol×2=0.075mol,根据Cu原子个数守恒可知Cu(NO3)2为0.075mol;根据 Cu2+—2OH—得NaOH 为 0.075mol×2=0.15 mol,则NaOH,溶液的体积V为0.15 mol/5mol/L=30mL,故选C。
【点睛】
本题主要考查了金属与硝酸反应的计算,根据氧化还原反应中电子得失守恒和原子个数守恒计算是解答的关键。
【题型】单选题
【结束】
26
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
【答案】蒸馏法电渗析法离子交换法还原 2NaCl(熔融)![]() 2Na+Cl2↑2NH4Cl+Ca(OH)2
2Na+Cl2↑2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
【解析】
海水淡化的常用方法有海水冻结法、电渗析法、蒸馏法、离子交换法;金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,原理就是利用氧化还原反应原理在一定条件下用还原剂把金属矿石中的金属离子还原成金属单质;实验室用消石灰与氯化铵共热的方法制备氨气,氨气溶于水溶液呈碱性,密度比水小;溴易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质。
(1)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等。(2)金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,工业上用电解熔融的氯化钠冶炼金属钠,反应的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2
2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
+3Br2+3H2O。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
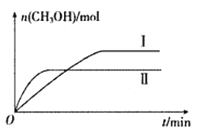
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
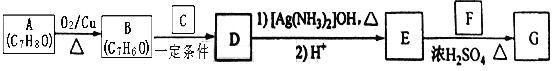
已知以下信息:
①![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为_________________ 。
(2)B和C反应生成D的化学方程式为___________________________________ 。
(3)F中含有官能团的名称为____________ 。
(4)E和F反应生成G的化学方程式为__________________,反应类型为_________ 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有________ 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为____________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C. 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D. 向FeO中加入稀硫酸:2FeO + 8H+ + SO42- =2Fe3+ + SO2 ↑+ 4H2O
【答案】B
【解析】
Fe(OH)3具有氧化性、I—具有还原性,二者反应生成I2和Fe2+;NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应;酸性条件下溶液中不存在OH-;向FeO中加入稀硫酸,发生复分解反应。
Fe(OH)3具有氧化性、I-具有还原性,二者反应生成I2和Fe2+,离子方程式为2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,A错误;NH4HSO3溶液与足量的NaOH溶液混合加热,足量的NaOH溶液电离出的OH-,既与NH4+反应,又与HSO3-反应,方程式符合客观事实,化学式书写正确,电荷和原子都守恒,B正确;酸性条件下KIO3溶液与KI溶液发生反应生成I2,正确的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,C错误;向FeO中加入稀硫酸, FeO与稀硫酸反应生成硫酸亚铁和水,D错误。本题选B。
【点睛】
题考查了离子方程式的书写,明确物质的性质、离子方程式书写规则即可解答,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
【题型】单选题
【结束】
19
【题目】为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了四种不同的方法,其中不可行的是
A. 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅
B. 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C. 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D. 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 金属元素和非金属元素一定形成离子化合物
B. 共价化合物中只有共价键,一定没有离子键
C. 含有金属阳离子的晶体未必是离子晶体
D. 离子化合物中可能含有极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是

A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
查看答案和解析>>
科目:高中化学 来源: 题型:
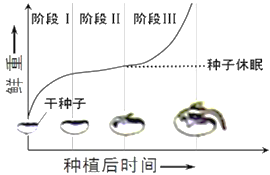
【题目】植物种子本身是非常好的实验材料,回答下面相关问题:
I.蓖麻种子的胚乳呈白色,脂肪含量为种子的70%。为探究该植物种子萌发过程中的物质变化,某研究小组将种子置于温度、水分(蒸馏水)、通气等条件适宜的黑暗环境中培养,定期检查萌发种子(含幼苗)的脂肪、蔗糖、葡萄糖的含量和干重,结果如图所示。回答下列问题:

(1)据甲图分析,萌发过程中胚乳组织中的脂肪酶催化脂肪水解成甘油、脂肪酸,并转变为______________作为胚生长和呼吸消耗的原料。
(2)蓖麻种子中脂肪含量较高,脂肪是脂质的一种,除此外,常见的脂质还有_____和固醇,其中固醇类物质包括胆固醇、_______、_______。胆固醇的作用是_______________。
(3)据乙图可知,蓖麻种子萌发初期时干重增加,导致萌发种子干种增加的主要元素是___________。 第7天至第10天萌发种子(含幼苗)的干重变化趋势是__________,原因是幼苗不能进行光合作用,呼吸作用消耗有机物超过脂肪转化增加的有机物。
II. 大豆种子萌发过程,干重和鲜重均发生变化,鲜重的变化曲线如图,图中阶段______种子胚细胞中自由水的含量最多。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com