
����Ŀ�������������G��![]() ����һ�����ϣ�һ�ֺϳ�·�����£�
����һ�����ϣ�һ�ֺϳ�·�����£�
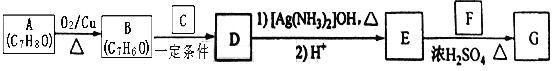
��֪������Ϣ��
��![]() ��
��
��CΪ��ȩ��ͬϵ���ͬ���������������������ܶȱ�Ϊ22��
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_________________ ��
��2��B��C��Ӧ����D�Ļ�ѧ����ʽΪ___________________________________ ��
��3��F�к��й����ŵ�����Ϊ____________ ��
��4��E��F��Ӧ����G�Ļ�ѧ����ʽΪ__________________����Ӧ����Ϊ_________ ��
��5��F��ͬ���칹���в���������Ʒ�Ӧ���������Ĺ���________ �֣������������칹�������к˴Ź�������ֻ������壬�ҷ������Ϊ3:1��Ϊ____________________��д�ṹ��ʽ����
���𰸡� ���״� ![]() �ǻ�
�ǻ� 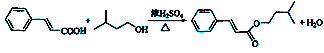 ȡ����Ӧ����������Ӧ�� 6
ȡ����Ӧ����������Ӧ�� 6 ![]()
�����������������A�IJ����Ͷ�Ϊ![]() =4��A����ϵ��ת���ϳ������������G��
=4��A����ϵ��ת���ϳ������������G��![]() ����
����
��A������������֪AΪ![]() ����BΪ
����BΪ![]() ��������Ϣ��֪��CΪ��ȩ��ͬϵ���ͬ
��������Ϣ��֪��CΪ��ȩ��ͬϵ���ͬ
���������������������ܶȱ�Ϊ22����CΪ��ȩ��B��C��ӦΪ��Ϣ������ȩ���Ϸ�Ӧ����DΪ
![]() ��EΪ
��EΪ![]() ��FΪ(CH3)2CHCH2CH2OH��
��FΪ(CH3)2CHCH2CH2OH��
��1��������������֪��AΪ![]() ������Ϊ���״���
������Ϊ���״���
�ʴ�Ϊ�����״���
��2��B��C��Ӧ����D�ķ�ӦΪ��Ϣ������ȩ���Ϸ�Ӧ����ѧ����ʽΪ��![]() +CH3CHO
+CH3CHO![]()
![]() +H2O��
+H2O��
�ʴ�Ϊ��![]() +CH3CHO
+CH3CHO![]()
![]() +H2O��
+H2O��
��3��FΪ(CH3)2CHCH2CH2OH�����й����ŵ�����Ϊ�ǻ���
�ʴ�Ϊ���ǻ���
��4��E��F��Ӧ����G�Ļ�ѧ����ʽΪ��![]() +(CH3)2CHCH2CH2OH
+(CH3)2CHCH2CH2OH![]()
![]() +H2O������������Ӧ��
+H2O������������Ӧ��
�ʴ�Ϊ��![]() +(CH3)2CHCH2CH2OH
+(CH3)2CHCH2CH2OH
![]()
![]() +H2O��������Ӧ��
+H2O��������Ӧ��
��5��(CH3)2CHCH2CH2OH��ͬ���칹�岻��������Ʒ�Ӧ��ֻ�����ѣ��ѵ��칹������ԭ��Ϊ�ֽ磺
����1��̼��4��̼����������������4���칹��������4���칹�壬����2��̼��3��̼����
������������2���칹��������2���칹�壬��6�֣����к˴Ź�������ֻ������壬�ҷ����
��Ϊ3��1��Ϊ(CH3)3COCH3��
�ʴ�Ϊ��6��(CH3)3COCH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ܱ��������м���һ�����ɻ����ĸ���(��Ȳ���)�������ֳ������֣�����߳���8molN2,�ұ߳���CO��CO2�Ļ�����干64g ʱ�����崦����ͼλ��(�����¶Ȳ���),����˵����ȷ����
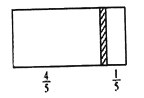
A. �ұ�CO��CO2������֮��Ϊ1:3
B. �Ҳ�CO������Ϊ14g
C. �Ҳ������ܶ�����ͬ�����������ܶȵ�2��
D. ���ı��ұ�CO��CO2�ij�������ʹ���崦�ھ����Ҷ�1/3���������¶Ȳ��䣬��ǰ�����γ�����������ڵ�ѹǿ֮��Ϊ5: 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.������ͼ��ʾ��ʵ���г����ļ���������
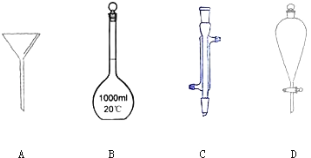
д������ĸ���������������������� A �� _____�� B �� _____�� C �� _____��D ��__��
�� ʵ�� ��Ҫ���� 500 mL 0.2 mo l/ L NaOH ��Һ ���� �� �� ���� ���⣺
��1����������ƽ��ȡ�������ƣ�������Ϊ _____g ��
��2�� ���� ��Ҫ�����������ȷ˳���� _____������ţ���
�� ��ȡһ���������������ƣ������ձ� �� ������������ˮ�ܽ⣻
�� ��ˮ��Һ��������ƿ���̶����� 1 -2 �� �� ʱ �� �� �� �� ͷ �� �� �� �� �� �� ˮ �� �� Һ �� �� �̶������У�
�� ����ȴ�����º���Һת�Ƶ� 5 0 0 mL �� �� ƿ �� ��
�� �Ǻ�ƿ�����������µߵ���ҡ�ȣ�
�� ������������ˮϴ���ձ��ڱںͲ����� 2 �� 3 �Σ�ϴ��Һת�Ƶ�����ƿ ����ҡ���� ƿ��ʹ��Ͼ��� ��
��3�� ʵ��������
�� ��� ʵ�� ���� �� ȱ�ٲ��� �� ����ʹ���Ƴ��� N a O H ��ҺŨ�� _____���� ��ƫ�� ������ƫ�� ���� ������ ������ͬ ��
�����ն���ʱ �� �ӹ۲�Һ�� ��ʹ���Ƴ��� NaOH ��ҺŨ�� _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ��������ܴ������棬���ҿ�����Ũ��������һ�������ǣ� ��
A.SO2��H2S��O2
B.CO��H2��Cl2
C.NO��H2��O2
D.HCl��CO��NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ���������װ�ûش�����:

��1����װ��A��װ��B�ж��õ���������װ��B�в�������������__________����ֹ����������Һ��ֲ����ȶ�������
��2��װ��C�Тٵ�������__________����ȴˮ�ķ�����__________��װ��D�ڷ�ҺʱΪʹҺ��˳��������Ӧ���еľ��������__________.
��3����ȥ����ˮ�е�Cl-��������ѡ��װ��__________(�����װ��ͼ����ĸ����ͬ)����������ˮ��Cl-�Ƿ�����ķ�����ȡ������ƿ�е�ˮ�ڽྻ�Թ������μ�__________����������ɫ��������Cl-�ѳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£�1���ˮ�����ܽ�500�����HCl���塣����ˮ��ͨ���״���µ�44.8 L HCl�������1 L��Һ������������ȫ�ܽ⣬������Һ�к�HCl�����ʵ���Ũ��Ϊ____________��������Һ�ܶ�Ϊ1.0g/cm3������Һ�к�HCl��������Ϊ________���Ӹ���Һ��ȡ��10 mLŨ�����ܽ���ˮ���Ƴ�250 mL��Һ�����ƺ��ϡ��Һ�к�HCl���ʵ���Ũ��Ϊ________������Ũ������������ϡ����ʱ�����������У�ʹ��ǰ�������Ƿ�©Һ��������________________�����ƹ����У����Ũ��ƫ�͵IJ���������________________(ѡ�����в��������)��
A������ƿ������ˮϴ��δ�Ӹ���
B����Ͳ������ˮϴ��δ����
C�����ձ���Ũ������������ƿ��δ��ˮϴ���ձ�����������ƿ�м�ˮ���̶�
D���ý�ͷ�ι�������ƿ�м�ˮʱ�����������̶��ߣ������⽺ͷ�ιܴ�ƿ������������Һʹʣ����Һ���ɴ�̶���
E������ʱ������Һ���ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ������˵���У���ȷ���ǣ� ��
A.��������ʵ��ܶȶ���ˮ�ᣬͶ��ˮ�ж��ܸ���ˮ����
B.�����������������ȼ�գ����ﶼ�ǹ�������
C.��������ʵ��۷е�һ������ԭ�ӵĵ��Ӳ��������������
D.��������ʶ��ǻ�ԭ�����仹ԭ�����ź˵�������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ��һ����Ũ����ǡ����ȫ��Ӧ���õ�����ͭ��Һ��NO2��N2O4��NO�Ļ�����壬����Щ������0.84LO2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣬ������������ͭ��Һ�м���5mol/L NaOH��Һ��Cu2+ǡ����ȫ����������NaOH��Һ�������
A. 60mL B. 45mL
C. 30mL D. 15mL
���𰸡�C
��������
����������ͭ��Һ�м���NaOH��Һ��Cu2+ǡ����ȫ����������ΪCu��OH��2���ɵ���غ��֪��Cu�ṩ�������ʵ�������������ͭ�������������ʵ���������NO2��NO�Ļ��������0.84L O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣬ�ݹ��������̣��ɵ���ת���غ㣬��֪Cu�ṩ���ӵ���������õĵ��ӣ��ݴ˼���n��NaOH��������������������������Һ�����
NO2��N2O4��NO���������0.84LO2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣬ˵�����������б���ԭ��HNO3��Ӧǰ��û�б仯����Cuʧȥ�ĵ��Ӷ���O2�õ��ˣ����ݵ�ʧ�����غ㽨����ϵʽ��n��Cu����2=n��O2����4�����n��Cu��0.0325mol��2=0.075mol������Cuԭ�Ӹ����غ��֪Cu��NO3��2Ϊ0.075mol������ Cu2+��2OH����NaOH Ϊ 0.075mol��2=0.15 mol����NaOH,��Һ�����VΪ0.15 mol/5mol/L=30mL����ѡC��
���㾦��
������Ҫ�����˽��������ᷴӦ�ļ��㣬����������ԭ��Ӧ�е��ӵ�ʧ�غ��ԭ�Ӹ����غ�����ǽ��Ĺؼ���
�����͡���ѡ��
��������
26
����Ŀ��(1)��ˮ�����ķ�����Ҫ�У�__________��______________��_____________��
(2)����ұ����ʵ���ǽ����������еĽ������ӵõ��ӱ�________������������������ԭ����Ϊ�������ʵĹ��̣�д��ұ�������ƵĻ�ѧ����ʽ��_________________________��
(3)ʵ��������ü�����κͼ�Ļ����ķ����ư���д��ʵ�����ư��Ļ�ѧ����ʽ��________��������ˮ�ð�ˮ����ˮ��___________�ԣ��������������������� �ܶȱ�ˮ_______����������������С����д����AlCl3��Һ�еμӹ�����ˮ�����ӷ���ʽ��_________________________��
(4)����Ҫ��Br����ʽ�����ں�ˮ�У���ҵ���Ʊ���Br2�IJ�������Ϊ��
��һ�������£���Cl2ͨ��Ũ���ĺ�ˮ�У�����Br2
�������ȿ�����Br2����������ŨNa2CO3��Һ���գ�����NaBr��NaBrO3��
���������ữ����ڵõ��Ļ���
Br2�����ȿ�����������ԭ���ǣ�_________��������������Ļ�ѧ��Ӧ����ʽΪ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����з���ʽ������������һ����Ϊͬϵ�����
A. C2H6O��C3H8O B. C6H6O��C7H8O������������
C. C4H8��C3H6 D. C7H8��C8H10������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com