
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是

A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
【答案】B
【解析】
本题以“冬小麦在不同时期含水量和呼吸速率变化关系图”为情境,考查学生对水的存在形式与功能、水的两种存在形式的转变与生理特性关系的识记和理解能力,以及获取信息、分析问题的能力。
分析图示可知:随气温的降低,结合水逐渐增加,自由水逐渐减少,使得结合水与自由水含量的比值增大,植物的抗寒性增强,A正确;总含水量下降是因为:植物的代谢速率随着温度的降低而降低,产生的各种化合物减少,导致细胞液浓度降低,进而使细胞吸收的水分减少,B错误;随着气温和土壤温度的下降,冬小麦植株中总的含水量也有所下降,C正确;水是细胞中含量最多的化合物,因此11月时,小麦细胞中含量最多的化合物仍是水,D正确。


科目:高中化学 来源: 题型:
【题目】在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是
A. 60mL B. 45mL
C. 30mL D. 15mL
【答案】C
【解析】
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与0.84L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积。
NO2、N2O4、NO混合气体与0.84LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,说明整个过程中被还原的HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒建立关系式:n(Cu)×2=n(O2)×4,解得n(Cu)0.0325mol×2=0.075mol,根据Cu原子个数守恒可知Cu(NO3)2为0.075mol;根据 Cu2+—2OH—得NaOH 为 0.075mol×2=0.15 mol,则NaOH,溶液的体积V为0.15 mol/5mol/L=30mL,故选C。
【点睛】
本题主要考查了金属与硝酸反应的计算,根据氧化还原反应中电子得失守恒和原子个数守恒计算是解答的关键。
【题型】单选题
【结束】
26
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
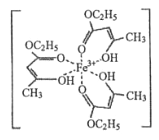
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为________________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
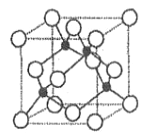
①该化合物的化学式为________________,A原子的配位数是______________。
②该化合物难溶于水,但易溶于氨水,其原因可能是________________;与NH3 互为等电子体的分子有________________(写化学式,一种即可)。 NH3 的键角大于H2O的键角的主要原因是_______________________。
③已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________________pm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中分子式所代表的物质一定互为同系物的是
A. C2H6O与C3H8O B. C6H6O与C7H8O(均含苯环)
C. C4H8与C3H6 D. C7H8与C8H10(均含苯环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________________。

(2)已知化学键键能是形成或拆开1 mol化学键放出或吸收的能量,单位kJ·mol-1。若已知下列数据:
化学键 | HH |
|
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1 ②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )

A. 分子式为C17H23O6
B. 不能与FeCl3溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. 1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com